
题目列表(包括答案和解析)
5.将少量金属钠分别投入下列物质的水溶液中,反应后溶液质量减轻的是( )
A.HCl B.K2SO4 C.NaOH D.CuSO4
思路解析:题意要求“反应后溶液质量减轻”是指投入金属钠的质量小于脱离溶液的物质(如气体或沉淀)的质量。在A、B、C三个选项中,钠反应后均只产生H2,由于反应进入溶液的钠元素质量大于放出的H2的质量,故溶液质量是增加的。D选项中钠与水反应生成的NaOH还能继续与CuSO4反应析出Cu(OH)2沉淀,其化学方程式为2Na+2H2O====2NaOH+H2↑,2NaOH+CuSO4====Cu(OH)2↓+Na2SO4。反应后溶液的质量减轻。
答案:D
4.下列叙述中不正确的是( )
A.钠原子有强还原性,钠离子有弱氧化性
B.若电解熔融的氯化钠,则钠离子被还原成钠原子
C.由于钠很活泼,所以它能从溶液中置换出金属活动顺序表钠后面的金属
D.钠是电和热的良导体
思路解析:钠原子最外层只有一个电子,易失去,而钠离子最外层已达8电子稳定结构,不会再失去电子,所以没有还原性,只有弱氧化性;电解熔融的氯化钠得到钠单质,化合价降低,被还原;钠与其他金属一样也是电和热的良导体。
答案:C
3.将一小块钠投入到硫酸铜溶液中,不可能观察到的现象是( )
A.钠熔化成小球在液面四处游动 B.有无色气体生成
C.溶液底部有紫红色物质生成 D.溶液中有蓝色沉淀生成
思路解析:钠投入硫酸铜溶液中,首先与水反应,然后生成的氢氧化钠与硫酸铜生成蓝色沉淀。所以本实验是钠与水反应的现象加上氢氧化钠与硫酸铜反应的现象。
答案:C
2.钠一旦着火,可用来灭火的物质是( )
A.水 B.沙子 C.煤油 D.干冰
思路解析:钠能与水反应,所以不能用水来灭火;煤油的密度比水大,钠会浮在煤油的上面,所以也灭不了火;干冰的主要成分是二氧化碳,能与钠反应。
答案:B
1.下列关于钠用途的叙述中,不正确的是( )
A.钠可用于制造高压钠灯,用于照明
B.钠可用于制造过氧化钠等化合物
C.钠和钾组成的合金可作为原子反应堆的导热剂
D.钠可将钛、锆、铌、钽等金属从它们的盐溶液中置换出来
思路解析:A、B、C三项中的用途都是教材上介绍的钠的用途,而钠投入盐溶液后,首先是与水反应,生成的氢氧化钠再与盐溶液作用,所以不能在盐溶液中发生金属之间的置换反应。
答案:D
4.钠的化学性质活泼,与水的反应也很剧烈,当我们将一粒金属钠投入一个盛有水(加几滴酚酞)的小烧杯中时,有哪些现象?这些现象又反映了金属钠的什么性质?
思路解析:钠与水的反应原理为:2Na+2H2O====2NaOH+H2↑,它所伴随的现象有:钠很快熔成闪亮的金属小球、浮在水面上、迅速在液面上游动、发出嘶嘶响声、溶液由无色变成红色。在做此实验的准备过程中,可用小刀将钠切割;切出的截面是银白色的,但很快变暗、发灰,最终是黄色的。
答案:钠很快熔成闪亮的金属小球、浮在水面上、迅速在液面上游动、发出嘶嘶响声、溶液由无色变成红色。钠的密度比水小、钠的硬度小、熔点低、生成的产物在水溶液中呈碱性、有气体产生且它能在空气中燃烧产生爆鸣声、反应为放热反应。
10分钟训练(强化类训练,可用于课中)
3.有人说金属表面的氧化膜是金属腐蚀的开始,也有人认为金属表面形成氧化膜后有助于金属防腐,你如何看待这两种观点?
思路解析:金属被氧化肯定是先从表面开始,进而氧化腐蚀内部,从这一点上讲,说金属表面的氧化膜是金属腐蚀的开始是完全正确的,而且很多金属当表面被氧化后,内部的氧化也确实会继续下去;但也有部分金属,如镁、铝等,当表面上形成了氧化膜后,就会阻止内部金属的进一步腐蚀,其原因是它的这一层氧化膜的结构致密,就相当于给内部金属增加了一层保护层,所以这一原理也被用于钢铁的防腐上,如枪炮的发蓝工艺就是在钢铁的表面上有意将表面金属氧化成一层四氧化三铁薄膜,而将内部金属给保护起来。
答案:都有一定道理,只是看问题的角度与前提不同。
2.通过右图可以发现地壳中金属含量最多的是铝,其次是铁,而铜却根本没有上榜,而人类利用铜的历史却是最悠久的,请谈谈你的看法。
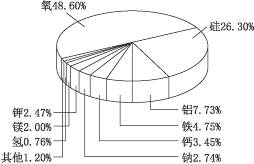
思路解析:金属的利用除了与含量多少的因素有关以外,还与金属的存在形态、开采、冶炼、煅造等技术有关。铜虽然含量不算高,但自然界有游离态的铜,人类最早利用的铜实际上就是陨石中的铜,加之铜的冶炼与开采技术也比较容易掌握,所以铜成了人类利用历史最为悠久的金属。
答案:自然界有游离态的铜,人类最早利用的铜实际上就是陨石中的铜,加之铜的冶炼与开采技术也比较容易掌握,所以铜成了人类利用历史最为悠久的金属。
1.(2010广东高考,6)等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.2 mol·L-1 H2SO4溶液 B.18 mol·L-1 H2SO4溶液
C.6 mol·L-1 KOH溶液 D.3 mol·L-1 HNO3溶液
思路解析:本题考查镁、铝的性质。Mg不与强碱溶液反应;常温下,铝与浓硫酸不反应,而Mg与浓硫酸和稀硝酸反应都不产生H2,而是放出SO2或NO;因此只有稀硫酸与Mg、Al反应时有H2放出。综合可得答案为A。
答案:A
9.在标准状况下进行下列实验,甲、乙、丙各取30.0mL同浓度的盐酸,加入同一镁、铝合金粉末产生气体,有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量(g) |
10 |
30 |
40 |
|
气体体积(L) |
11.2 |
22.4 |
22.4 |
(1)盐酸的物质的量浓度为______mol·L-1,在表中可作为计算依据的是(填写实验序号,要求全部写出):___________________________________。
(2)根据实验序号______中的数据,可计算出镁、铝合金中镁和铝的物质的量之比为___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com