
题目列表(包括答案和解析)
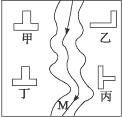
15.在一条鱼虾几乎绝迹的小河边从上游到下游依次有四座工厂--甲、乙、丙、丁,它们排出的废液里,每厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍清。
请完成下列各题:
(1)四座工厂排出的废液里含有的污染物是:
甲_____________,乙,_____________,丙_____________,丁_____________。(填化学式)
(2)在丁的下游M处取出的河水中,肯定含有的离子是______________。
(3)小河中鱼虾几乎绝迹的原因是________________________________________________。
思路解析:甲处河水呈乳白色说明含有Ca(OH)2;乙处河水呈红褐色,说明乙处含有FeCl3;甲处的Ca(OH)2随河水流下与FeCl3反应生成氢氧化铁红褐色沉淀;丙处河水由浑变清说明此处有盐酸使上游流下来的沉淀溶解;丁处有气泡说明此处有Na2CO3,与上游流下来的盐酸反应产生二氧化碳。
答案:(1)Ca(OH)2 FeCl3 HCl Na2CO3
(2)Na+、Ca2+、Fe3+、H+、Cl-
(3)河水中的酸碱性及有害化学药品的富集作用等原因直接危害鱼虾等生物的生长,因而此河中鱼虾几乎绝迹
14.某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Cu2+、OH-、Cl-、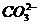 、
、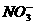 。现进行如下实验:
。现进行如下实验:
(1)用红色石蕊试纸检验,试纸变蓝色。
(2)另取少量溶液逐滴滴加盐酸至过量,无气体放出,再加入BaCl2溶液后,没有沉淀生成。
(3)另取少量溶液用硝酸酸化后,加入AgNO3溶液有白色沉淀生成。
根据上述实验推断:原溶液中肯定有_______________离子,肯定没有________________离子,不能肯定存在______________离子。
思路解析:由题干“无色溶液”排除Cu2+(蓝色)的存在;由实验①知有OH-的存在,无Mg2+;由实验②知无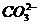 ;由实验③知有Cl-的存在。整个实验过程中
;由实验③知有Cl-的存在。整个实验过程中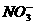 的存在,不影响整个实验的过程,故不能确定
的存在,不影响整个实验的过程,故不能确定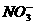 是有还是无(可通过其他的实验证明
是有还是无(可通过其他的实验证明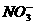 存在与否)。
存在与否)。
答案:OH-、Na+、Cl- Mg2+、Cu2+、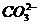
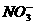
13.下列物质中能导电的是_____________________,属于电解质的是__________________,属于非电解质的是____________________。
①汞 ②液氨 ③氯水 ④氯化钠晶体 ⑤盐酸 ⑥干冰 ⑦液氯 ⑧金刚石
思路解析:根据电解质、非电解质的概念可以完成以上问题。而导电的物质则是看其中是否有可自由移动的带电粒子。
答案:①③⑤ ④ ②⑥
12.A、B、C、D分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象是:①A与B或C混合都产生沉淀;②C与B或D混合也产生沉淀;③D与B混合产生无色气体。完成下列问题:
(1)写出D与B反应的离子方程式:_____________________________________________。
(2)这四种溶液分别是A:______________、B:_______________、C:______________、
D:__________________。
思路解析:该题中最有特征的现象是D与B混合产生无色气体,说明D与B由盐酸和碳酸钠组成,而盐酸和碳酸钠中既能与氯化钙又能与硝酸银反应产生沉淀的只能是碳酸钠,故B是碳酸钠,D是盐酸,C是硝酸盐,A是氯化钙。
答案: (1)2H++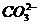 ====H2O+CO2↑
====H2O+CO2↑
(2)氯化钙 碳酸钠 硝酸银 盐酸
11.A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是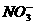 、
、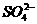 、Cl-、
、Cl-、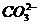 中的某一种。
中的某一种。
①若把四种盐分别溶解于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色。
②若向①的四支试管中分别加盐酸,B盐溶液有沉淀生成,D盐溶液有无色无味气体逸出。根据①②实验事实可推断它们的化学式为:
A_________________、B_________________、C_________________、D________________。
思路解析:首先,因A、B、C、D都是可溶性盐,故Ba2+不能与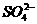 、
、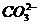 组合;Ag+只能与
组合;Ag+只能与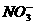 组合;Cu2+不能与
组合;Cu2+不能与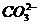 组合。
组合。
由①可知,C为铜盐。
由②可知,B盐为AgNO3,D盐含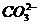 ,而
,而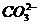 与Ba2+、Ag+、Cu2+均不能共存,故D只可能为Na2CO3。余阳离子为Ba2+,故A含之;余阴离子为
与Ba2+、Ag+、Cu2+均不能共存,故D只可能为Na2CO3。余阳离子为Ba2+,故A含之;余阴离子为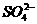 、Cl-,而Ba2+与
、Cl-,而Ba2+与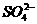 不能共存,故A只可能是BaCl2,因而C为CuSO4。
不能共存,故A只可能是BaCl2,因而C为CuSO4。
答案:BaCl2 AgNO3 CuSO4 Na2CO3
10.下列离子方程式中不正确的是( )
A.亚硫酸钡与盐酸反应:BaSO3+2H+====Ba2++SO2↑+H2O
B.少量二氧化碳通入足量的NaOH溶液:CO2+OH-====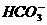
C.澄清石灰水跟盐酸反应:H++OH-====H2O
D.亚硫酸氢钠溶液与NaOH溶液反应: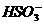 +OH-====
+OH-====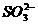 +H2O
+H2O
思路解析:少量的CO2通入足量的NaOH溶液中,应生成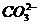 。正确的写法为:CO2+2OH-====
。正确的写法为:CO2+2OH-====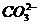 +H2O。A、C、D是正确的。
+H2O。A、C、D是正确的。
答案:B
9.下列各组离子在溶液中可以大量共存,且加入氨水后也不产生沉淀的是( )
A.Na+、Ba2+、Cl-、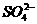 B.K+、
B.K+、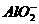 、
、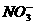 、OH-
、OH-
C.H+、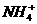 、Al3+、
、Al3+、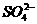 D.H+、Cl-、CH3COO-、
D.H+、Cl-、CH3COO-、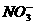
思路解析:A中Ba2+和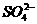 会生成沉淀,不能共存;C中的四种离子能共存,但加入氨水后Al3+会产生Al(OH)3沉淀;D中的H+和CH3COO-会形成难电离的物质CH3COOH,也不能共存。
会生成沉淀,不能共存;C中的四种离子能共存,但加入氨水后Al3+会产生Al(OH)3沉淀;D中的H+和CH3COO-会形成难电离的物质CH3COOH,也不能共存。
答案:B
8.下列各组中的离子,能在溶液中大量共存的是( )
A.Na+、Mg2+、Cl-、OH-
B.H+、Ca2+、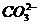 、
、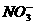
C.Cu2+、K+、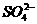 、
、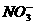 D.Na+、
D.Na+、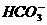 、OH-、Ca2+
、OH-、Ca2+
思路解析:离子能否大量共存是考查离子反应的常见题型。主要考查角度有:一看能否反应产生难溶物,二看能否反应产生挥发性物质,三看能否生成弱电解质。本题A中Mg2+和OH-能起反应生成Mg(OH)2沉淀;B中H+和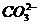 、Ca2+和
、Ca2+和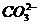 都能起反应;C中的离子相互不起反应,可以大量共存;D中的
都能起反应;C中的离子相互不起反应,可以大量共存;D中的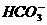 和OH-、Ca2+和OH-都能起反应。要理解和掌握
和OH-、Ca2+和OH-都能起反应。要理解和掌握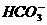 的特性。
的特性。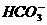 既能与H+反应,又能与OH-反应,
既能与H+反应,又能与OH-反应,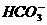 +H+====CO2↑+H2O,
+H+====CO2↑+H2O,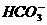 +OH-====
+OH-====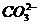 +H2O。
+H2O。
答案:C
7.下列离子方程式中正确的是( )
A.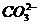 +H+====CO2↑+H2O
B.Cu+Zn2+====Cu2++Zn
+H+====CO2↑+H2O
B.Cu+Zn2+====Cu2++Zn
C.Zn(OH)2+2H+====Zn2++2H2O
D.Cl-+AgNO3====AgCl↓+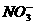
思路解析:离子方程式不仅要原子守恒,而且要电荷守恒;离子方程式也必须符合反应事实。A项电荷和原子都不守恒;B项不符合反应事实,因为铜不能将锌置换出来;D项中的硝酸银应写离子。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com