
题目列表(包括答案和解析)
6.实验过程中要注意控制温度、压强、溶液的浓度等条件,因为同样的反应物在不同的条件下,会有不同的反应。
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的产物不改变的是( )
A.Na和O2 B.NaOH和CO2 C.Na2O2和CO2 D.木炭(C)和O2
思路解析:Na和O2反应时,若在常温下缓慢氧化,则生成Na2O;若点燃,则生成Na2O2。NaOH和CO2随反应物的用量不同,产物不同,氢氧化钠过量时生成Na2CO3,二氧化碳过量时,生成NaHCO3。木炭(C)在O2中燃烧,若充分燃烧,则生成二氧化碳,若不充分燃烧,则生成一氧化碳。Na2O2和CO2无论条件如何、用量如何,反应后都生成碳酸钠和氧气。
答案:C
5.化学美表现在很多方面,化学物质的美丽颜色就是其中一个重要的方面。下列物质中,有一种物质的颜色与其他三种的颜色不同,这种物质是( )
A.NaOH B.Na2O C.Na2O2 D.NaHCO3
思路解析:题目所列的四种物质中,NaOH、Na2O、NaHCO3都是白色的,只有Na2O2是淡黄色的。
答案:C
4.2010年5月24日夜间,一辆油罐车在贝宁经济首都科托努以北500多千米的波尔加起火,事故现场发现了23具被烧焦的尸体,造成至少35人死亡,60多人受伤。这辆由科托努开往贝宁北部的油罐车因发生故障停在路边,附近的居民用管子偷吸油罐车里的汽油时,其中一人携带的油灯引燃了油罐车。
近年来,我国许多城市禁止汽车使用含铅汽油,其主要原因是( )
A.提高汽油燃烧效率 B.降低汽油成本
C.避免铅污染大气 D.防止铅与汽油反应
思路解析:禁止使用含铅汽油的主要原因是防止铅污染大气;铅不与汽油反应;加铅,汽油成本并不能降低,也不能提高汽油燃烧效率。
答案:C
3.下列有水参加的反应,其中是氧化还原反应且水既不是氧化剂又不是还原剂的是( )
A.钠跟水 B.氧化钠跟水 C.过氧化钠跟水 D.电解水
思路解析:将四个化学反应的化学方程式写出后分析其中水分子中氢、氧元素的化合价变化情况,如果反应前后都没有变化,则满足题干的要求。
答案:C
2.向饱和Na2CO3溶液中通入过量的CO2,将出现什么现象?为什么?
思路解析:CO2将与Na2CO3、H2O反应生成NaHCO3,Na2CO3+H2O+CO2====2NaHCO3,由方程式知:充分反应后生成的NaHCO3质量肯定大于原溶液中的Na2CO3质量,而Na2CO3的溶解度大于NaHCO3,故生成的NaHCO3不能完全溶解,出现了白色沉淀。一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。要掌握NaHCO3的这一特性。
答案:将出现白色沉淀。由于Na2CO3的溶解度大于NaHCO3,CO2与Na2CO3、H2O充分反应后生成NaHCO3质量肯定大于原溶液中的Na2CO3质量,而水的质量有所减少,故出现了白色沉淀。
1.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,可观察到的现象为( )
A.溶液仍为紫色 B.溶液最终变为蓝色
C.最终溶液褪色,而无其他现象 D.溶液中有气泡产生,溶液最终变为无色
思路解析:2Na2O2+2H2O====4NaOH+O2↑,有氧气产生,故溶液中有气泡放出,又因为Na2O2有漂白性,故溶液最终变为无色。不能只考虑反应生成NaOH,认为溶液变为蓝色,而忽略Na2O2有漂白性。
答案:D
10.埋藏在地下的青铜器锈蚀过程可以表示为:
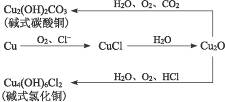
(1)青铜器锈蚀过程中的产物有__________________________________________________。
(2)青铜器出土后防止青铜器继续锈蚀的关键是____________________________________。
思路解析:青铜器锈蚀过程中的产物从图中可以清楚看出。从图中看出锈蚀反应的条件是存在O2、水及酸性气体如CO2、HCl等,其中O2是关键。
答案:(1)CuCl,Cu2O,Cu2(OH)2CO3,Cu4(OH)6Cl2等 (2)与H2O和O2等隔绝
快乐时光
唯一的乞丐
一群犹太人站在巷子里,每人都在为自己祝福,有的想成为富翁,有的想娶富翁的女儿,
有的祝愿妻子能生个小孩。在这群人中间有一个乞丐,他也喃喃地对天祈祷着什么。
“喂!”有人问他,“您为自己祈祷什么呀?”
“我祝愿自己是这座城市里唯一的乞丐。”
30分钟训练(巩固类训练,可用于课后)
9.今用铝、稀硫酸和氢氧化钠溶液为原料,实验室制备一定量的氢氧化铝。分别采用如下化学方程式所表示的两种方法:
①2Al+3H2SO4====Al2(SO4)3+3H2↑ Al2(SO4)3+6NaOH====2Al(OH)3↓+3Na2SO4
②2Al+2NaOH+2H2O====2NaAlO2+3H2↑ 2NaAlO2+H2SO4+2H2O====2Al(OH)3↓+Na2SO4
(1)请问上述哪一种方法比较节约试剂。(提示:以每生产2 mol Al(OH)3所耗费的试剂用量予以说明)
(2)原料相同,请设计一种更为节约试剂的方法。(以方程式表示,并说明其可以最节约试剂的根据)
思路解析:(1)从化学方程式看出,同样是制备2 mol的Al(OH)3,方法①所需原料为:2 mol Al,3 mol H2SO4,6 mol NaOH;而方法②所需原样为:2 mol Al,1 mol H2SO4,2 mol NaOH。
(2)①2Al+3H2SO4====Al2(SO4)3+3H2↑
②2Al+2NaOH+2H2O====2NaAlO2+3H2↑
③Al2(SO4)3+6NaAlO2+12H2O====8Al(OH)3↓+3Na2SO4
由方程式看出,制备8 mol的Al(OH)3,所需原料为:8 mol Al、3 mol H2SO4、6 mol NaOH。相当于制备2 mol Al(OH)3,所需量为:2 mol Al,3/4 mol H2SO4,3/2 mol NaOH,其用量为最少。
答案:(1)第②种方法比较节约试剂。
(2)见解析。(方程式①和②的顺序可交换)
8.若将含HCl 0.20 mol的稀盐酸滴入0.15 mol Na2CO3的溶液中,经充分反应后,溶液中各溶质的物质的量为(单位:mol)( )
|
|
Na2CO3 |
HCl |
NaCl |
NaHCO3 |
|
A |
0 |
0 |
0.05 |
0.10 |
|
B |
0.5 |
0 |
0.20 |
0 |
|
C |
0 |
0 |
0.20 |
0.10 |
|
D |
0 |
0.05 |
0.15 |
0.15 |
思路解析:盐酸和Na2CO3反应,与滴加顺序有关,应引起足够重视。
分析本题可知两条重要信息:(1)因稀盐酸是滴入到Na2CO3溶液中的,所以这种情况下盐酸和碳酸钠的反应是分步进行的:
Na2CO3+HCl====NaCl+NaHCO3①
NaHCO3+HCl====NaCl+CO2↑+H2O ②
(2)反应物盐酸的量相对于Na2CO3的第一步反应是过量的(余0.05 mol),相对于Na2CO3的完全反应是不足量的(差0.10 mol)。这样利用题示信息进一步分析可知:充分反应后反应物Na2CO3和HCl都已消耗完全;两步反应中的HCl都转化为NaCl,其转化关系为1∶1(物质的量之比)。因此生成的NaCl为0.2 mol;而NaHCO3的量则经一步反应生成0.15 mol(按不足量),第二步反应又转化了(放CO2)0.05 mol,最后剩0.10 mol。
答案:C
7.拉曼光谱证实溶液中不存在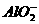 ,实际存在[Al(OH)4]-。200
mL 0.2 mol·L-1 Na[Al(OH)4]溶液与250 mL 0.2 mol·L-1 H2SO4混合,完全反应后,溶液中Al3+与
,实际存在[Al(OH)4]-。200
mL 0.2 mol·L-1 Na[Al(OH)4]溶液与250 mL 0.2 mol·L-1 H2SO4混合,完全反应后,溶液中Al3+与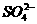 物质的量之比为( )
物质的量之比为( )
A.4∶5 B.2∶3 C.2∶5 D.1∶2
思路解析:2Na[Al(OH)4]+H2SO4====Na2SO4+2Al(OH)3↓+2H2O,
2Al(OH)3+3H2SO4====Al2(SO4)3+6H2O。
按反应方程式分两步计算:第一步,硫酸过量,剩余硫酸为0.3 mol,生成氢氧化铝0.2 mol;第二步,两种反应物恰好反应,生成硫酸铝,此时溶液中Al3+为0.2 mol,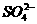 为0.5 mol。
为0.5 mol。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com