
题目列表(包括答案和解析)
1.19世纪中叶,门捷列夫的突出贡献是 ( )
A.提出了原子学说 B.发现了元素周期律
C.提出了分子学说 D.制定了科学完整的元素周期表
11.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg====Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显_______________价。
(2)以上反应中的氧化剂为_____________________,当有1 mol CuI参与反应时,转移电子_______________mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
Cu2++I-→CuI+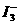
思路解析:标注元素的化合价:CuI中Cu为+1,I为-1;Cu2HgI4中I为-1价,Cu 若为+2价,则Hg为0价,Cu若为+1价,Hg为+2价,很明显,Cu取+1价比较合理。
根据化合价变化情况,可以判断出CuI发生了歧化,既是氧化剂,又是还原剂。
答案:(1)+1
(2)CuI 0.5
(3)2 5 2 1
10.毒气一般是通过呼吸道等途径进入人体引起死亡的,因此,在毒气现场必须穿防护衣和戴防毒面具。有一种生氧防毒面具,它由面罩、生氧罐、呼气管和吸气管等组成。使用时,人体呼出的气体经呼气管进入生氧罐,干燥后,二氧化碳与罐中的过氧化钠(Na2O2)反应,产生氧气和碳酸钠,氧气沿吸气管进入面罩。请在框内画出上述防毒面具的工作原理图,并写出产生氧气的化学方程式。
化学方程式_____________________________________________________________________。
思路解析:本题看似复杂,实际是过氧化钠的生氧作用,它要求学生对防毒面罩中二氧化碳与氧气的循环过程的原理清楚。
答案: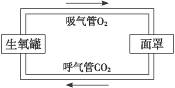
2Na2O2+2CO2====O2+2Na2CO3
9.38 g Na2CO3和NaHCO3的混合物,可与300 g HCl所占质量分数为7.3 %的盐酸恰好完全反应。求原混合物中Na2CO3所占质量分数。
思路解析:混合物中Na2CO3和NaHCO3都将与HCl发生反应,可利用两个已知量列方程组解该题。
答案:反应中消耗的HCl质量为300 g×7.3%=21.9 g
因此可设混合物中含Na2CO3的质量为x,NaHCO3的质量为y。则有:
Na2CO3+2HCl====2NaCl+CO2↑+H2O
106 g 73 g
x 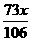
Na2CO3+2HCl====2NaCl+CO2↑+H2O
84 g 36.5 g
y 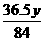
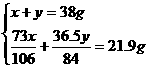
解得:x=21.2 g (Na2CO3)
y=16.8 g (NaHCO3)
1.68 g x
168 g∶16.8 g=62 g∶x
x=6.2 g
固体的质量减少6.2 g
8.将16.8 g NaHCO3充分加热,固体质量将减少多少?
思路解析:NaHCO3受热分解为Na2CO3、H2O和CO2,所得固体为Na2CO3,减少的是H2O和CO2质量之和。注意常见的错误是认为固体减少的质量是生成的CO2的质量。
答案:设固体减少的质量为x。
2NaHCO3====Na2CO3+H2O+CO2↑ Δm
168 g 62 g
0.3 mol·L-1×0.2 L4×0.3 mol·L-1×0.2 L
得2×0.2 mol·L-1×0.2 L+4×0.3 mol·L-1×0.2 L=4×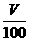 ,即V=80 mL。
,即V=80 mL。
答案:C
0.2 mol·L-1×0.2 L2×0.2 mol·L-1×0.2 L
Al3+ - 4OH-
7.有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为( )
A.40 Ml B.72 mL C.80 mL D.128 mL
思路解析:欲使Mg2+全部转化成沉淀并从溶液中分离出来,应向溶液中加入过量的NaOH溶液,使Mg2+、Al3+全部沉淀后,再使Al(OH)3恰好溶解。设c(Al3+)=x,根据电荷守恒,则有:
3x+2c(Mg2+)=c(Cl-),即3x+2×0.2 mol·L-1=1.3 mol·L-1,解得x=0.3 mol·L-1。
设NaOH溶液的体积为V,根据关系式则有:
Mg2+ - 2OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com