
题目列表(包括答案和解析)
3.氢键
(1)一些氢化物的沸点有所反常:
,因为这些分子间存在 。
(2)氢键的形成示意图:
(3)氢键的实质
(4)对性质的影响使 。
水结冰时体积膨胀,密度减小,也可用氢键解释。在气态水、液态水、固态水(冰)中,没有氢键的是 。
2. 影响因素:
对组成和结构相似的物质,相对分子质量越大,分子间作用力 ,物质的熔点、沸点也 。
熔、沸点顺序:F2 Cl2 Br2 I2 熔、沸点:CF4 CCl4 CBr4 CI4
1.概念:分子间作用力-- 又叫范德华力。分子间作用力存在于_______之间。而化学键是分子内 。分子间作用力比化学键 。从什么实验事实可以证明分子间存在相互作用
。
2.离子晶体的熔点、沸点与离子键的强弱有关。一般地讲,化学式与结构相似的离子晶体,阴、阳离子半径越小,离子键越强,熔、沸点越高。如:KCI<NaCI<NaF。
思考:熔、沸点高低顺序:NaF NaCl NaBr NaI
1.离子间通过离子键结合而成的晶体叫 晶体。构成离子晶体的微粒是 。离子晶体中,阳离子和阴离子间存在着较强的 ,因此,离子晶体一般硬度 ,密度 ,熔、沸点 。
2、要检验AlCl3是离子化合物还是共价化合物可用什么方法?
总结:
4. 离子晶体的判断
(1)如何判断一种晶体是离子晶体
方法一:由化合物种类分:离子化合物一定为离子晶体。
方法二:由晶体的性质来分:①根据导电性:固态时不导电而熔化时能导电的一般为离子晶体。
②根据机械性能:具有较高硬度,且脆的为离子晶体。
*延伸知识:晶胞知识及折算、如何由晶胞来求算晶体的化学式
构成晶体的结构粒子是按着一定的排列方式所形成的固态群体。在晶体结构中具有代表性的最小重复单位叫晶胞。
根据离子晶体的晶胞,求阴、阳离子个数比的方法---均摊法
①处于顶点上的离子:同时为8个晶胞共有,每个离子有1/8属于晶胞。
②处于棱上的离子:同时为4个晶胞共有,每个离子有1/4属于晶胞。
③处于面上的离子;同时为2个晶胞共有,每个离子有1/2属于晶胞。
④处于体心的离子:则完全属于该晶胞。
具体计算:
(1) CsCl晶胞:一个小立方体即为一个晶胞。一个CsCl晶胞里含粒子数的计算:
Cs+的数目: Cl-的数目: 每个CsCl晶胞中含有 个CsCl。
(2) NaCl晶胞:一个大立方体为一个晶胞,由8个小立方体构成。
Na+的数目: Cl-数目: 在晶胞中Na+与Cl-个数比为 . 每个NaCl晶胞中含有 个NaCl。
(3)
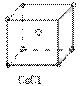 以中心Na+为依据,画上或找出三个平面(主个平面互相垂直)。在每个平面上的Na+都与中心 Na+最近且为等距离。每个平面上又都有4个Na+,所以与Na+最近相邻且等距的Na+为3×4=12个。结论:在Na+周围与它最近时且距离相等的 Na+共有
个,在Cl-周围与它最近时且距离相等的 Cl-共有
个。
以中心Na+为依据,画上或找出三个平面(主个平面互相垂直)。在每个平面上的Na+都与中心 Na+最近且为等距离。每个平面上又都有4个Na+,所以与Na+最近相邻且等距的Na+为3×4=12个。结论:在Na+周围与它最近时且距离相等的 Na+共有
个,在Cl-周围与它最近时且距离相等的 Cl-共有
个。
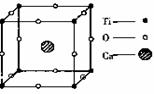 对应练习:1、在高温超导领域中,有一种化合物叫钙钛矿,其晶体结构中有代表性的最小单位结构如图所示,试回答:
对应练习:1、在高温超导领域中,有一种化合物叫钙钛矿,其晶体结构中有代表性的最小单位结构如图所示,试回答:
(1)在该晶体中每个钛离子周围与它最近且相等距离的钛离子有多少个?
(2)在该晶体中氧、钙、钛的粒子个数比是多少?
3.离子晶体的物理性质
(1)离子晶体的硬度 ,熔点、沸点都 ,因为 。
(2)离子晶体固态时不导电。但 或 却能导电。
2.晶体结构:
●认识NaCl晶体结构图:
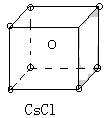
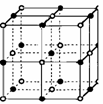
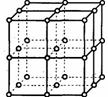 (1)仔细观察教材,请将其代表Na+的用笔涂黑圆点,方法:以中心的点为Na+,在Na+周围与它最近时且距离相等的 Cl-共有
个。每个Cl-周围也同时吸引着 个Na+。
(1)仔细观察教材,请将其代表Na+的用笔涂黑圆点,方法:以中心的点为Na+,在Na+周围与它最近时且距离相等的 Cl-共有
个。每个Cl-周围也同时吸引着 个Na+。
|
|
●认识CsCl晶体结构图:标注Cs+、Cl-离子的位置。
每个Cl-同时吸引着 个Cs+,每个Cs+也同时吸引着 个Cl-。
●注意:在离子晶体中存在单个的分子吗?NaCl、CsCl是分子式吗?
。
1. 概念:离子化合物均是离子晶体。
如 、 、 、 、 。
离子晶体-- 。对定义的理解:离子晶体的构成粒子是 ,粒子间的作用力为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com