
题目列表(包括答案和解析)
6.总结
(1)相邻原子间通过共价键结合而成空间网状结构的晶体属于离子晶体。
(2)构成原子晶体的微粒是 。原子间以较强 相结合,而且形成 结构。键能大。原子晶体的熔点和沸点高,硬度大。
(3)同种晶体:若同为原子晶体,成键的原子半径越小,键长越短,键能越大,晶体熔点越高:如金刚石>SiC>Si。
5.判断晶体类型的依据
(1)看构成晶体的微粒种类及微粒间的相互作用。
对分子晶体,构成晶体的微粒是______________,微粒间的相互作用是___________;
对于离子晶体,构成晶体的是微粒是______________,微粒间的相互作__________键。
对于原子晶体,构成晶体的微粒是_______,微粒间的相互作用是___________键。
(2)看物质的物理性质(如:熔、沸点或硬度)。
一般情况下,不同类晶体熔点高低顺序是 ________晶体>_______晶体>_______晶体。
同类晶体的熔沸点高低要分析粒子间作用力的强弱。
4.掌握几种典型的晶体
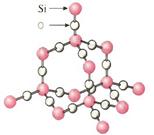
SiO2晶体结构:
晶体中每个Si原子与 个O原子形成四个共价键,
 每个O原子又与 个Si原子结合形成硅、氧四面体,
每个O原子又与 个Si原子结合形成硅、氧四面体,
再向空间发展成立体网状的晶体。
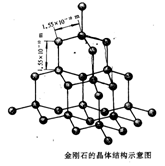
金刚石晶体结构:
(1)每个碳原子与周围相邻的4个碳原子形成
结构,四条C-C键之间的夹角为109028,类似于甲烷。
(2)晶体中最小的碳原子环含碳原子数是 。
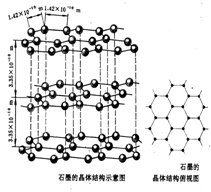 *过渡型晶体(混合型晶体)--石墨
*过渡型晶体(混合型晶体)--石墨
(1)层内存在 键,层间以
结合
(2)在层内每个碳原子与其他
个碳原子以共价键结合,形成平面网状结构
(3)石墨晶体中碳原子与C-C键数之
比为 。
3.常见的原子晶体有____ _____等。
2.物理性质
 (1)熔、沸点________,硬度_________。 (2) ________一般的溶剂。(3) ____导电。
(1)熔、沸点________,硬度_________。 (2) ________一般的溶剂。(3) ____导电。
原子晶体具备以上物理性质的原因 。
原子晶体的化学式是否可以代表其分子式 。
1.概念:相邻原子间以 相结合而形成的空间网状结构的晶体。定义理解:构成粒子______________ 粒子间的作用______________。
3.组成相似的分子,极性分子的熔、沸点大于非极性分子,如:SO2>CO2
2.一般来说,对于组成和结构相似的物质,分子间作用力随着相对分子质量增加而 ,物质的熔点、沸点也 。例如:F2<Cl2<Br2 <I2 、 CF4<CCl4<CBr4<CCl4、CO2<CS2等。
1.分子间通过分子作用力相结合的晶体叫 晶体。构成分子晶体的微粒是 。分子晶体中,由于分子间作用力较 ,因此,分子晶体一般硬度较 ,熔、沸点较 。
4.分子晶体
(1)定义:____________________ ______
(2)构成微粒______________ __________________
(3)分子晶体一般物质类别________________________________
(4)分子晶体的物理性质:常温下通常为 态,所以熔沸点
 (因
),硬度 。分子晶体无论是液态时,还是固态时,存在的都是分子,不存在可以导电的粒子(阴、阳离子或电子),故分子晶体熔融或固态时都不导电,由此性质,可判断晶体为分子晶体。
(因
),硬度 。分子晶体无论是液态时,还是固态时,存在的都是分子,不存在可以导电的粒子(阴、阳离子或电子),故分子晶体熔融或固态时都不导电,由此性质,可判断晶体为分子晶体。
*5. 干冰晶体空间结构:
[例]在干冰晶体中每个CO2分子周围距离相等且最近的
CO2分子有_______个。 平均每个CO2晶胞中含
个CO2分子。
小结:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com