
题目列表(包括答案和解析)
12. 近来, 科学家研制了一种新型的乙醇电池(DEFC), 它用磺酸类质子作溶剂, 在200℃左右时供电, 乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为: C2H5OH+3O2
 2CO2+3H2O。
2CO2+3H2O。
下列说法不正确的是( )
A. C2H5OH在电池的负极上参加反应
B. 1 mol乙醇被氧化转移6 mol电子
C. 在外电路中电子由负极沿导线流向正极
D. 电池正极得电子的物质是O2
[解析]选B。由原电池反应的原理, 原电池中负极发生氧化反应, 正极发生还原反应, 乙醇在反应中被氧化, 发生氧化反应, 则表明乙醇在负极上发生反应, 故A项正确; B项中, 由电池的总反应式可知, 1 mol乙醇被氧化, 同时有3 mol O2被还原, 则转移的电子为3 mol×4=12 mol, 故B项不正确; 外电路中电子流向和电流流向相反, 即从负极流向正极, 所以C项正确; 在正极上发生反应的物质是O2, O2得电子, 所以D项正确。
11. 某温度下, 在一固定容积的容器中进行反应H2(g)+I2(g) 2HI(g), 下列情况一定能说明反应已达到平衡状态的是( )
2HI(g), 下列情况一定能说明反应已达到平衡状态的是( )
A.  压强不再随时间而改变时
压强不再随时间而改变时
B. 气体的总质量不再改变时
C. 混合气体中各组成成分的含量不再改变时
D. 单位时间内每消耗1 mol I2, 同时有2 mol HI生成时
[解析]选C。判断一反应是否达到平衡状态, 从宏观上看各种成分的量是否再发生改变, 从微观上看正、逆反应速率是否相等。因为此反应中各成分均为气体且反应前后气体的物质的量相等, 所以无论是否达到平衡, 压强和质量都不发生改变, 故A、B两项不正确。消耗I2与生成HI的方向均为正反应方向, D项不能证明正反应速率与逆反应速率相等, 故D不正确。
10.(2009·武汉高一检测)向四个体积相同的密闭容器
中分别充入一定量的SO2和O2, 开始反应时, 按正反应速率
由大到小的顺序排列, 正确的是( )
①500 ℃, 10 mol SO2和5 mol O2反应
②500 ℃, 用V2O5作催化剂, 10 mol SO2和5 mol O2反应;
③450 ℃, 8 mol SO2和5 mol O2反应
④500 ℃, 8 mol SO2和5 mol O2反应。
①②③④ B.②①③④
C.②①④③ D.④③②①
[解析]选C。本题主要考查影响化学反应速率的因素, 所涉及的影响因素为浓度、温度和催化剂。反应速率最快的一定是有催化剂的②; ③和④比较当然是500℃时比
450℃时快, 故反应速率由大到小的顺序为: ②①④③。
9. 将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧, 这样处理的目的是( )
①使煤充分燃烧, 提高煤的利用率
②减少SO2的产生,  避免造成“酸雨”
避免造成“酸雨”
③减少有毒的CO产生, 避免污染空气
④减少CO2的产生, 避免“温室效应”
A. ①②③ B. ②③④ C. ①③④ D. ①②③④
[解析]选A。煤块粉碎是为了燃烧更充分, 提高利用率, 减少CO的产生, 但不能减少CO2的产生, 脱硫处理是为了减少SO2的产生, 避免造成“酸雨”。
8. 氢气在氯气中燃烧时产生苍白色火焰。在反应过程中, 破坏1 mol 氢气中的化学键消耗的能量为Q1 kJ, 破坏
1 mol 氯气中的化学键消耗的能量为Q2 kJ, 形成1 mol 氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中, 正确的是( )
A. Q1+Q2>Q3 B. Q1+Q2>2Q3
|
[解析]选D。氢气在氯气中燃烧: Cl2+H2 ====2HCl, 该反应放出热量, 即反应中形成化学键所释放的能量大于断裂化学键所吸收的能量。在反应中, 要破坏1 mol H-H键、1 mol Cl-Cl键, 形成2 mol H-Cl键, 所以2Q3-(Q1+Q2)>0, 即Q1+Q2<2Q3。
7. 下列每组物质中含有的化学键类型相同的是( )
A. NaCl、HCl、H2O、NaOH
B. Cl2、Na2S、HCl、SO2
C. HBr、CO2、H2O、CS2
D. Na2O2、H2O2、H2O、O3
[解析]选C。解此类题目的关键在于弄清各类化学键的形成本质。离子键是由阴、阳离子相互作用形成的, 非极性键是由同种元素原子形成的共价键, 极性键是由不同种元素原子形成的共价键。A项中NaCl与NaOH中含有离子键, 而HCl和H2O中只有共价键, NaOH中也含有共价键; B项Cl2、HCl、SO2中只含有共价键, 而Na2S中只含离子键; 而C项中均含有共价键; D项中Na2O2含离子键、共价键, H2O2、H2O、O3中只含共价键, 故C项正确。
6. (2009·山东高考)2SO2(g)+O2(g) 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 增大反应体系的压强反应速率一定增大
C. 该反应是放热反应, 降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻, SO3(g)的浓度分别是c1,
c2,
则时间间隔t1-t2内, SO3(g)生成的平均速率为u= 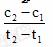
[解析]选D。加入催化剂同时改变正、逆反应速率, A项错误; 若是恒容条件, 增加不参与反应的气体而使反应体系的压强增大, 由于浓度不变, 反应速率就不变, B项错误; 降低温度使反应速率降低, 将增大反应达到平衡的时间, C项错误; 根据计算平均速率的定义公式可得D项正 确。
确。
5. (2010·连云港高一检测)下列化合物中, 阴离子半径和阳离子半 径之比最大的是(
)
径之比最大的是(
)
A. LiI B. NaBr C. KCl D. CsF
[解析]选A。第ⅦA族元素阴离子半径大小顺序是I->Br->Cl->F-, 第ⅠA族元素阳离子半径大小顺序是Cs+>K+>Na+>Li+, 故阴离子半径和阳离子半径之比最大的是LiI。
4. 具有下列结构的原子, 其元素一定属于ⅡA族元素的是( )
A. 最外层电子数与次外层电子数 相等的原子
相等的原子
B. M层电子数为K层电子数一半的原子
C. 最外层有2个电子的原子
D. M层电子数等于其内层电子数之和1/5的原子
[解析]选D。解题时应根据原子的核外电子排布规律, 推断出具体的元素在周期表中的位置, 再进行判断。A中最外层电子数可能是2, 也可能是8, 所以A错; K层电子数的一半为1, 所以肯定不在ⅡA族; 最外层有2个电子的原子可以是He也可以是过渡元素, 所以也不一定在ⅡA族; D中原子的内层电子数为10, 则M层电子数为2, 即为12号元素Mg, 属于ⅡA族, 所以D正确。
3. 钾的金属活动性比钠强, 根本原因是( )
A. 钾的密度比钠的小
B. 钾原子的电子层比钠原子多一层
C. 钾与水反应比钠与水反应更剧烈
D. 加热时, 钾比钠更易汽化
[解析]选B。金属活动性属于化学性质, 化学性质决定于(原子)结构。钾有4个电子层, 而Na只有3个电子层; 最外层电子数相等, 原子核对外层电子的引力K
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com