
题目列表(包括答案和解析)
1.我国古代曾用火烧孔雀石的方法炼铜。孔雀石的主要成分是Cu2(OH)2CO3,其冶炼方法是( )
A.焦炭还原法 B.湿法炼铜
C.铝热还原法 D.电解冶炼法

21.(14分)(2009·泰安模拟)有A、B两位学生均想利用原电池反应验证金属的活动性顺序, 并探究产物的有关性质, 分别设计了如图所示的原电池, 请回答:
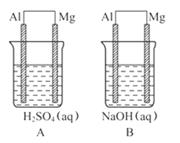
(1)指出各原电池中的负极材料并写出其电极反应式。
①负极材料:
A池_________, B池_______。
②电极反应式:
A池: 正极:__________________________________ ,
负极:______________________________________ 。
B池: 正极:__________________________________ ,
负极 :
______________________________________。
:
______________________________________。
(2)B池总反应的离子方程式为_________________。
(3)上述实验证明了“利用金属活动性顺序表直接判断原电池正、负极”, 这种作法_______(填“可靠”或“不可靠”), 如不可靠请你提出另一种判断原电池正、负极的可行方案___________ 。 (若你认为可靠, 此空可不做答)
(4)从构成原电池的几个组成部分来看, 判断原电池负极, 除了要考虑金属的活泼性外, 还要考虑_________
___________________________________________。

答案: (1)①Mg Al
②2H+ +2e- ==== H2↑
Mg-2e- ==== Mg2+
2H2O+2e- ==== 2OH- +H2↑
Al+4OH--3e-
==== 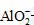 +2H2O
+2H2O
(2)2Al+2OH-
+2H2O
==== 2 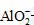 +3H2↑
+3H2↑
(3)不可靠 将两种金属电极连上电流计而构成原电池, 利用电流计检测电流的方向, 从而判断电子流动方向, 由此确定原电池正、负极
(4)①电解质溶液的性质; ②较易与电解质溶液反应的金属作原电池的负极
20.(15分)下表为元素周期表的一部分, 请参照元素①-⑧在表中的位置, 用化学用语回答下列问题:
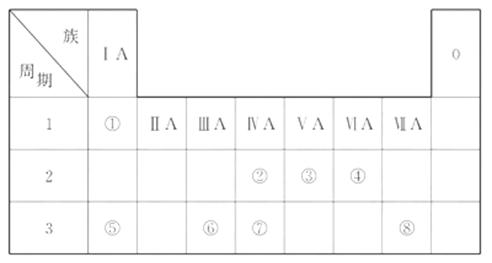
(1)④、⑤、⑥的原子半径由大到小的顺序为_______(填元素符号)。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_______________(填化学式)。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物, 写出其中一种化合物的电子式: ______________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解, 可使用的催化剂为(填序号)_________________。
a. MnO2 b. FeCl3 c. Na2SO3 d. KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为_________________,
N→⑥的单质的化学方程式为___________________。
[解析]本题以元素周期表为题材,
考查原子半径比较, 酸性强弱、电子式、离子方程式以及盐类水解等知识。(1)⑤⑥位于同一周期, 且⑤排在⑥的前面, 原子半径大, 而④在上一周期, 比⑤、⑥少一个电子层, 故半径最小。(2)②⑦位于同一主族, 上面的非金属性强, 最高价含氧酸酸性强, ②③位于同一周期, 且③在后, 非金属性强, 对应的酸性强。(3)四种元素分别为氢、氧、钠和氯, 离子键显然必须是钠盐, 极性共价键则应有两种非金属元素组成。
且⑤排在⑥的前面, 原子半径大, 而④在上一周期, 比⑤、⑥少一个电子层, 故半径最小。(2)②⑦位于同一主族, 上面的非金属性强, 最高价含氧酸酸性强, ②③位于同一周期, 且③在后, 非金属性强, 对应的酸性强。(3)四种元素分别为氢、氧、钠和氯, 离子键显然必须是钠盐, 极性共价键则应有两种非金属元素组成。
(4)液态H2O2可以在MnO2、FeCl3等催化剂作用下发生分解反应。(5)⑥为Al, 可推断Z为Al(OH)3, 受热分解可产生Al2O3, 再电解即可得单质铝。M仅含非金属的盐, 显然为铵盐, 所以X与Y应为AlCl3与NH3·H2O的反应, 生成NH4+Cl。由于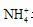 水解, 故要使其浓度与Cl-
相等, 则要补充NH3·H2O。
水解, 故要使其浓度与Cl-
相等, 则要补充NH3·H2O。
答案: (1)Na>Al>O
(2)HNO3>H2CO3>H2SiO3
(3) 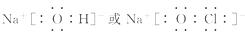
(4)a、b
(5)Al3+ +3NH3·H2O==== Al(OH)3↓+3
2Al2O3(熔融)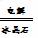 4Al+3O2↑
4Al+3O2↑
19. (4分)已知拆开1 mol H-H键、1 mol I-I键、
1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、
299 kJ。则由氢气和碘反应生成1 mol HI需要______(填“放出”或“吸收”)______ kJ的热量。氢气、碘和碘化氢三种分子最稳定的是_________。
[解析]根据 反应H2+I2 ==== 2HI, 形成2 mol HI放出2×299 kJ的热量, 所以生成1 mol HI时放出热量为
反应H2+I2 ==== 2HI, 形成2 mol HI放出2×299 kJ的热量, 所以生成1 mol HI时放出热量为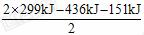 =5.5
kJ。
=5.5
kJ。
键能越大, 分子越稳定, 故H2分子最稳定。
答案: 放出 5.5 H2
18. (4分)T ℃时, 向10 L的密闭容器中同时充入6 mol H2和2 mol N2,
2 min末测得生成NH3 1. 2 mol, 前2 min内用N2表示的平均反应 速率是______, N2的转化率是___________________________________________,
H2的转化率是_________________。
速率是______, N2的转化率是___________________________________________,
H2的转化率是_________________。

17. (9分)现有如下两个反应:
(A)NaOH+HCl==== NaCl + H2O
(B)2FeCl3+Cu ==== 2FeCl2+CuCl2
(1)根据两反应本质, 判断能否设计成原电池______。
(2)如果不能, 说明其原因_ ____________________。
____________________。
(3)如果可以, 则写出正、负极材料及其电极反应式, 电解质溶液名称_______________________________
___________________________________________。
[解析]原电池反应原理是氧化还原反应, 发生电子转移, 而中和反应为非氧化还原反应, 故不能设计为原电池, 反应2FeCl3+Cu ==== 2FeCl2+CuCl2可以设计成原电池, Cu失电子被氧化, 为负极, 电解质溶液为FeCl3溶液, 正极材料可以使用C或Pt。
答案: (1)(A)不能, (B)可以
(2)(A)的反应为非氧化还原反应, 没有电子转移
(3)负极: 铜, Cu-2e- ==== Cu2+,
正极: 碳棒, 2Fe3+ +2e- ==== 2Fe2+,
电解质溶液: 氯化铁溶液
16.(9分)氢元素的原子结构特殊, 目前学术界对它在周期表中的位置仍存在争议。
(1)现行元素周期表, 将氢元素排在第_____族, 依据是______________________________________。
(2)目前已制取了金属氢化物, 如NaH、KH、CaH2等, 其中氢元素显______价, 所以有人认为氢元素也可以排在第_______族, 依据是___________________________。
(3)根据活泼金属氢化物已制取的事实, 有人根据氢元素正、负化合价特点, 认为氢还可以排在第_____族, 依据是________________________________________。
(4)人们普通倾向于采用现行教材中“元素周期表”排列方式, 你认为其理由是_______________________。
[解析]元素周期表中同主族元素及其化合物结构和化学性质相似。根据氢原子结构和性质确定氢元素在周期表中的 位置。(1)氢原子核外只有1个电子, 与碱金属元素原子最外层电子数相同, 氢元素在绝大多数化合物中显+1价, 与碱金属元素在化合物中显+1价相似, 所以, 现行元素周期表将氢排在第ⅠA族, 所以, 碱金属位于第ⅠA族, 但不能说位于第ⅠA族的元素都是碱金属。(2)在金属氢化物中, 钠、钾、钙元素都显正化合价, 所以氢元素显-1价, 与金属卤化物中卤族元素化合价相同, 所以, 氢元素也可以排在第ⅦA族。
位置。(1)氢原子核外只有1个电子, 与碱金属元素原子最外层电子数相同, 氢元素在绝大多数化合物中显+1价, 与碱金属元素在化合物中显+1价相似, 所以, 现行元素周期表将氢排在第ⅠA族, 所以, 碱金属位于第ⅠA族, 但不能说位于第ⅠA族的元素都是碱金属。(2)在金属氢化物中, 钠、钾、钙元素都显正化合价, 所以氢元素显-1价, 与金属卤化物中卤族元素化合价相同, 所以, 氢元素也可以排在第ⅦA族。
(3)氢元素有+1价和-1价, 其正化合价与负化合价绝对值相等, 类似于CH4、SiH4中碳、硅元素有+4价(最高化合价)、-4价(最低化合价), 且其绝对值相等, 所以, 有人认为氢还可以排在第ⅣA族。(4)元素周期表首先要具有科学性, 其次考虑美观、对称等审美因素。如果将氢排在第ⅣA族, 显得孤单, 排在第ⅦA族, 显得不对称, 且氢在化合物中主要表现+1价, 综合考虑上述因素, 现行元素周期表将氢元素排在第ⅠA族。
答案: (1)ⅠA 氢原子核外只有1个电子, 在绝大多数化合物中氢显+1价, 与碱金属原子结构和化合价相似(2)-1 ⅦA 氢原子得到1个电子达到稳定结构, 与卤素原子相似 (3)ⅣA 氢元素最高化合价与最低化合价绝对值相等, 与第ⅣA族碳、硅元素的“最高正化合价与最低负化合价绝对值相等”相似
(4)排在第ⅠA族, 元素周期表显得对称、美观, 且氢在绝大多数化合物中显+1价
15. 对于可逆反应2SO2+O2  2SO3,
在混合气体中充
2SO3,
在混合气体中充
入一定量的18O2, 足够长的时间后, 18O原子( )
A. 只存在于O2中
B. 只存在于O2和S O3中
O3中
C. 只存在于O2和SO2中
D. 存在于S O2、O2和SO3中
O2、O2和SO3中
[解析]选D。该反应为可逆反应, 加入18O2后, 它与SO2反应生成SO3, 因此SO3中会有18O原子, 含有18O原子的SO3会部分分解为SO2和O2, 18O原子可能进入O2中, 也可能进入SO2中, 因此最后SO2、O2和SO3中都会有18O原子。
第Ⅱ卷(非选择题 共55分)
14. (多选)将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。在每次实验时, 记录电压表指针的偏转方向和电压表的读数如表所示:
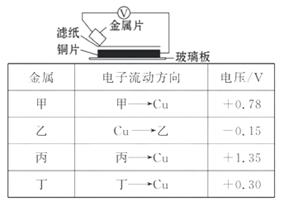
请依据记录数据判断, 下列有关说法正确的是( )
A. 在四种金属中丙的还原性最强
B. 金属乙能从硫酸铜溶液中置换出铜
C. 甲、乙若形成原电池时, 甲为正极
D. 甲、乙形成合金时, 将该合金露置在空气中, 甲先被腐蚀
[解析]选A、D。两种金属作电极构成原电池时, 所产生的电压越大, 说明两金属的活动性相差越大, 所以甲、丙、丁三种金属相比较: 丙最活泼、甲次之、丁第三, 乙中电压表与其他三项偏转方向相反, 说明乙的活泼性比铜差。
13. 某同学按如图所示的装置做实验,并把实验情况记录于下面, 其中叙述
合理的是( )
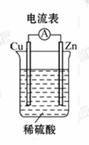
①锌为正极, 铜为负极
②电解质溶液的pH不变
③电流表 的指针发生偏转
的指针发生偏转
④铜极上有气泡产生
⑤锌极上仍有少量气泡产生
⑥溶液中的阳离子向负极移动
A. ①②③ B. ③④⑤ C. ③④⑥ D. ②③④
[解析]选B。Zn的活泼性大于Cu, 锌作负极, 铜作正极, ①错; 反应过程中消耗H+, pH增大, ②错; 电流表中有电流通过, 指针偏转, ③正确; 铜为正极, 铜极上生成H2, ④正确; ⑤Zn和杂质构成微型原电池, 也会看到Zn极上有少量气泡, ⑤正确; ⑥阳离子应向正极移动, ⑥错, 故选B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com