
题目列表(包括答案和解析)
3.关于卤族元素的下列叙述中正确的是( )
A.卤族元素是典型的非金属元素,因此不能与其他非金属元素反应
B.卤族元素单质越活泼,其熔点和沸点就越高
C.卤族元素单质都能与水剧烈反应
D.卤族元素单质都能和氢气反应,且生成的气态氢化物的稳定性随单质氧化性的增强而增强
[解析]选D。卤族元素位于周期表中第ⅦA族,均为非金属元素,能与H2化合生成卤化氢,均能与水反应,只有F2反应相当剧烈,卤素单质的活泼性与其物理性质没有直接关系,故选 D。
2.下列离子中,电子数大于质子数,且质子数大于中子数的是( )
A.D3O+ B.Li+ C.OD- D.OH-
[解析]选D。D3O+ 的质子数为11,电子数为10,中子数为11;Li+ 的质子数为3,电子数为2,中子数为4;OD- 的质子数为9,电子数为10,中子数为9;OH- 的质子数为9,电子数为10,中子数为8,故选D。
1.2007年10月24日,中国第一颗探月卫星“嫦娥一号”在西昌卫星发射中心成功升空。“嫦娥一号”担负的四大科学使命之一是探测下列14种元素的含量和分布情况:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、
Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中属于主族元素的有( )
A.4种 B.5种 C.6种 D.7种
[解析]选D。元素周期表中元素分主族、副族、0族和第Ⅷ族元素,属于主族元素的有:第ⅠA族(Na,K),第ⅡA族(Mg,Ca),第ⅢA族(Al),第ⅣA族(Si),第ⅥA族(O),共7种。铁为第Ⅷ族元素,其他为副族元素。
16.(15分)乙酸乙酯是无色具有水果香味的液体,沸点77.2 ℃,某同学制取它用冰醋酸14.3 mL,95%的乙醇 23 mL,还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液。主要仪器如图所示。
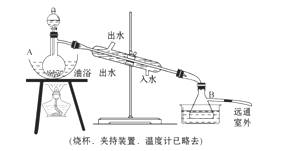
实验步骤是:
①先向A中蒸馏烧瓶注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里两种有机物的物质的量之比约为5∶7。
②加热油浴保温约135 ℃-145 ℃。
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完全。
④保持油浴温度一段时间,至不再有液体流出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批、少量、多次地加到馏出液里,边加边摇荡,至无气泡产生为止。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是_____。
(2)用过量乙醇的主要目的是_____。
(3)用饱和Na2CO3溶液洗涤粗酯的目的是_____。如果用NaOH浓溶液代替Na2CO3溶液将引起的后果是_____。
(4)用饱和CaCl2溶液洗涤粗酯的目的是_____。
(5)为什么操作③要使加料与馏出的速度大致相等?
_______________________。
(6)在⑧所示的粗酯里还含有的杂质是_____。
[解析]在制取乙酸乙酯的实验中浓H2SO4的作用是催化剂和吸水剂。通常加入的乙醇要过量,这样既加快反应速率又有利于平衡向生成乙酸乙酯的方向移动,同样促进平衡正移且提高乙酸的转化率。因乙酸和乙醇均易挥发,所以制取的乙酸乙酯中含有杂质乙酸和乙醇,因饱和Na2CO3溶液能与乙酸反应,溶解乙醇且降低乙酸乙酯的溶解度,因此可用饱和Na2CO3溶液来洗涤粗酯。因浓NaOH能使乙酸乙酯水解,故不能用浓NaOH代替饱和Na2CO3溶液。据信息知饱和CaCl2溶液是吸收粗酯中可能残留的乙醇,这样再分液后得到的粗酯中的杂质就只有水了。
答案:(1)催化剂和吸水剂
(2)促进平衡向生成乙酸乙酯的方向移动,有利于乙酸乙酯的生成
(3)除去乙酸乙酯中的乙酸和乙醇
致使乙酸乙酯水解
(4)除去乙酸乙酯中的乙醇
(5)让产生的乙酸乙酯及时蒸馏出来,使蒸馏烧瓶内压强一定,从而得到平稳的蒸气气流
(6)水
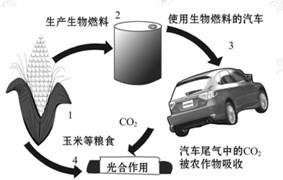
15.(12分)你注意到汽车加油站内的标牌了吗?某些省市加油站提供的汽油标号由90#、93#换成了E90、E93,后者是在汽油中加入了10%的燃料乙醇而制得的乙醇汽油。
燃料乙醇的生产过程由下图表示:
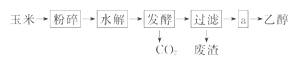
(1)粉碎玉米的目的是_____ 。
(2)生产过程中为了检验淀粉水解是否完全,可使用的试剂是_____ 。
(3)步骤a的操作是_____ 。
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途: _____ 、 _____ 。
(5)以玉米等淀粉原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+nH2O 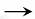 nC6H12O6
nC6H12O6
C6H12O6 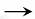 2C2H5OH+2CO2
2C2H5OH+2CO2
根据上述反应式,可以算出100 kg淀粉理论上可生产无水乙醇_____kg。(相对分子质量:C-12 H-1 O-16)
(6)下图是燃料乙醇的生产和消费过程示意图。虽然燃料乙醇的使用缓解了汽车能源的紧张状况,但仍存在一些问题。由此可知,燃料乙醇_____ 。
A.是最理想的绿色能源
B.提供的能量来自于太阳能
C.生产和消费过程对空气没有任何影响
D.生产过程中将消耗大量粮食,以避免粮食过剩
[解析](1)粉碎玉米是增大反应物的接触面积,加快反应速率,提高原料的利用率。
(2)因为淀粉遇I2变蓝,只要有淀粉存在,加I2一定会变蓝,因此可用I2或碘酒来检验淀粉是否完全水解。
(3)滤去滤渣后得到的是水和乙醇的混合溶液,由于水和乙醇互溶,但沸点不同,乙醇的沸点低于水,用蒸馏的方法可使乙醇从混合物中分离出来。
(4)纯度为99%的CO2可以很好的利用,因为CO2可以作碳酸饮料,还可以制干冰,还可以制纯碱或制碳酸钙等。

(6)据图可知,CO2在光合作用下通过植物生成玉米等粮食,通过发酵等生成乙醇,乙醇在汽油中燃烧不产生污染物,但要有光能存在才能循环,也消耗掉大量粮食,消费过程中产生大量的CO2会产生温室效应,故选B。
答案:(1)增大反应物的接触面积,从而提高反应速率(2)I2 (3)C
(4)制饮料 制干冰 制纯碱等(写出两种即可)
(5)56.8 (6)B
3.125∶4.2∶3.644=6∶8∶7。
n(O2)=1.01 L÷22.4 L·mol-1=0.045 mol,1 mol A完全燃烧消耗4.5 mol O2,设A的分子式为(C6H8O7)n,
(C6H8O7)n+4.5O2
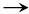 6nCO2+4nH2O,n=1,则A的分子式为C6H8O7。(2)A+3NaHCO3
6nCO2+4nH2O,n=1,则A的分子式为C6H8O7。(2)A+3NaHCO3
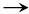 3CO2,A分子中含有3个
3CO2,A分子中含有3个
-COOH;又因为它与乙酸可发生酯化反应,说明A还含有醇羟基,又A分子中含7个氧原子,所以,A分子含1个醇羟基。A分子中含有8个氢,3个-COOH,1个醇羟基(-OH)共占4个氢,所以,还有4个氢与碳原子直接相连,即含2个
-CH2COOH,4个与碳直接相连的氢完全相同,即2个
-CH2COOH处于对称位置;(3)A分子含醇羟基、羧基,脱水方式有:①消去羟基和氢生成碳碳双键;②羧基和羟基脱去水生成酯;③两个羧基脱水生成酸酐。
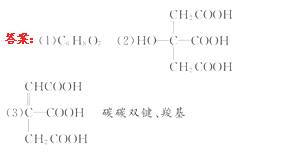
14.(13分)已知化合物A中各元素的质量分数分别为
C:37. 5%,H:4.2%和O:58.3%。请填空:
(1)0.01 mol A在空气中充分燃烧需要消耗氧气1.01 L(标准状况),则A的分子式是_____。
(2)实验表明:A中不含-CHO。1 mol A与足量的碳酸氢钠溶液反应可以放出3 mol二氧化碳。在浓硫酸催化下,A与乙酸可发生酯化反应。A分子中有4个位置相同的氢原子。则A的结构简式是_____ 。
(3)A失去1分子水后形成化合物C,写出C的一种可能的结构简式_____ 。所含官能团名称: _____。
[解析](1)n(C)∶n(H)∶n(O)=(37.5/12)∶(4.2/1)∶(58.3/16)=
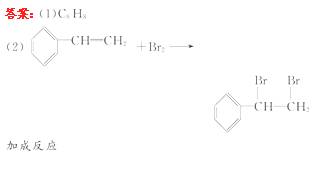
13.(12分)某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1)A的分子式为_____ ;
(2)A与溴的四氯化碳溶液反应的化学方程式为_____ ,反应类型是_____ ;

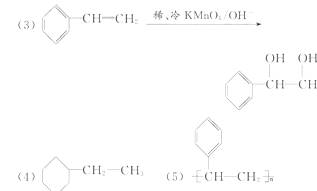
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式_____ ;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为_____ 。
[解析](1)m(C)=92.3%×104=96,则m(H)=8,此含量不可能含其他原子,则96÷12=8,所以分子式为C8H8;
(2)该分子中含苯环,且分子能与溴的四氯化碳溶液反应,所以A应为乙烯基苯,该反应为加成反应;
(3)分子中有碳碳双键,直接套用信息可得结果;
(4)加氢反应,若只加成碳碳双键,则含H 9.43%,若苯环也加氢,则含H 14.3%,后者符合题意。
(5)按碳碳双键的加聚反应写即可。
12.分子式为C5H10O2的酯共有(不考虑立体异构)( )
A.7种 B.8种 C.9种 D.10种
[解析]选C。为了不出现遗漏,写的时候可以按如下分类来写:甲酸丁酯4种(丁基4种异构)、乙酸丙酯2种(丙基2种异构)、丙酸乙酯1种、丁酸甲酯2种(丁酸的烃基为丙基,丙基2种异构)共9种。
[讲台挥洒一刻]
有机物同分异构体的书写技巧
(1)书写同分异构体时,必须遵循“价键数守恒”原则,即在有机物分子中,碳原子价键数为4,氢原子价键数为1,氧原子价键数为2。
(2)熟练掌握碳原子数小于5的烷烃和碳原子数小于4的烷基的异构体数目,这对同分异构体的判断与书写十分重要。
即CH4、C2H6、C3H8、-CH3、-C2H5仅有1种结构;
C4H10、-C3H7有2种结构;-C4H9有4种结构;
C5H10有3种结构。
(3)熟练掌握不同官能团之间的类别异构情况。
①饱和一元羧酸、饱和一元酯:通式为CnH2nO2(n≥2)
②葡萄糖与果糖;蔗糖与麦芽糖
(4)苯的同系物或苯的衍生物的同分异构体的书写,应首先根据苯环上取代基的个数来考虑苯环上的位置异构,再考虑苯环取代基的碳架异构和官能团异构。
(5)书写同分异构体的步骤是:首先考虑官能团异构,然后在本官能团的类别中考虑碳架异构,最后考虑位置异构。同时应遵循对称性、互补性、有序性,既可以做到不重复,又不遗漏。
11.(2010·青岛高一检测)下列关于有机物的说法中,不正确的是( )
A.液化石油气和天然气的主要成分都是甲烷
B.苯、乙醇和乙酸都能发生取代反应
C.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
D.用新制的Cu(OH)2悬浊液可检验尿液中的葡萄糖
[解析]选A。液化石油气主要成分为碳原子数较少的烃
类物质,A错误;苯能发生取代反应生成 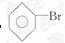 、
、
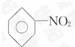
等乙醇能与乙酸发生酯化反应(属取代反 应),B正确;工业上利用油脂的皂化反应来制取肥皂,C
正确;可用新制Cu(OH)2悬浊液来检验尿液中的葡萄糖,D正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com