
题目列表(包括答案和解析)
16.(12分)某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)相同的盐酸和硫 酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:原因Ⅰ:Cl- 对反应具有促进作用,而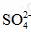 对反应没
有影响; 原因Ⅱ:
_________________________________;
对反应没
有影响; 原因Ⅱ:
_________________________________;
原因Ⅲ:Cl-
对反应具有促进作用,而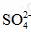 对反应具有阻
碍作用;
对反应具有阻
碍作用;
原因Ⅳ:Cl-
、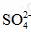 都对反应具
都对反应具 有促进作用,但Cl- 影响更 大;
有促进作用,但Cl- 影响更 大;
原因Ⅴ: _________________________________。
(2)该同学设计进行了两组实验,即得出了正确的结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
①在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化。
②在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
③若 观察到实验①中_____ ,实验②中_____ ,则说明原因Ⅲ是正确的。依此类推。该同学通过分析实验现象,得出了结论:Cl- 对反应具有促进作用。
观察到实验①中_____ ,实验②中_____ ,则说明原因Ⅲ是正确的。依此类推。该同学通过分析实验现象,得出了结论:Cl- 对反应具有促进作用。
[解析]围绕铝片与盐酸反应速率更快,对照已知原因,容易推出其他原因。原因Ⅲ中,Cl- 对反应有促进作用, 则实验①速率应加快,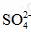 对反应具有阻碍作用,则实验 ②速率减慢。
对反应具有阻碍作用,则实验 ②速率减慢。
答案:(1)Cl-
对反应没有影响,而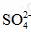 对反应具有阻碍 作用 Cl- 、
对反应具有阻碍 作用 Cl- 、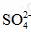 都对反应具有阻碍作用,但Cl- 影响 更小
都对反应具有阻碍作用,但Cl- 影响 更小
(2)反应速率加快 反应速率减慢
15.(16分)在200 ℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:
I2(g)+H2(g) 2HI(g)。
2HI(g)。
(1)反应刚开始时,由于c(H2)=____,c(I2)= ___,
而c(HI)= _____ ,所以化学反应速率_____最大,而_____最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)_____ ,c(I2)_____ ,而c(HI)_____ ,
从而化学反应速率v(正) _____ ,而v(逆) _____ 。
(3)当反应进行到v(正)与v(逆) _____时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的 总压强(或各组分的分压)都将_____ 。
总压强(或各组分的分压)都将_____ 。
[解析]主要考查化学平衡建立的过程,开始时,c(H2)和c(I2)为最大值,正反应速率最大,由于此时没有HI,逆反应速率最小为0,随着反应进行c(H2)和c(I2)越来越小,正反应速率越来越小,逆反应速率逐渐变大,直到平衡时,v(正)=v(逆)。
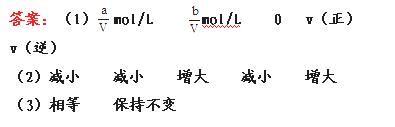
14.(12分)如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
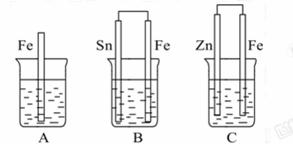
(1)A中反应的离子方程式为_____。
(2)B中Sn极的电极反应式为_____Sn极附近溶液的pH值_____(填“变大”、“变小”或“不变”)
(3)C中被腐蚀的金属是_____,总反应的化学方程式为____,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为_____(填序号)。
[解析]B中Fe比Sn活泼,Fe为负极,Sn为正极,电极反应为:2H+ +2e- ====H2↑,C中,Zn比Fe活泼,Zn为负极,Fe为正极,Fe不被H2SO4腐蚀,而A中,Fe与H2SO4直接反应,故A、B、C中铁被腐蚀的速率快慢为B>A>C。
答案:(1)Fe+2H+ ====Fe2+ +H2↑
(2)2H+ +2e- ====H2↑ 变大
(3)Zn Zn+H2SO4====ZnSO4+H2↑ B>A>C
13.(12分)(2010·浦东高一检测)(1)1 mol H2完全燃烧时放热286 kJ,而每千克汽油完全燃烧时约放热
46 000 kJ,H2被公认为是21世纪的理想能源,试通过计算和分析比较,简述H2作为能源的3个主要优点:
① _______________________________________ ,
② _______________________________________ ,
③ _______________________________________ 。
(2)某化学反应,设反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为_____热反应,该反应过程可以看成_____。中和反应都是_____热反应,其实质是_____。
[解析](1)作为理想的能源,要具备来源广、易得到、产生热量多、有利于保护环境等条件。通过计算可知燃烧相同质量的H2和汽油,H2放出的热量多。
(2)要熟悉常见放热反应以及理解放热反应的实质。
答案:(1)①可以用水作为原 料制备氢气,来源丰富,可以再生
料制备氢气,来源丰富,可以再生
②单位质量的氢气燃烧比单位质量的汽油燃烧产生的热量多
③氢气燃烧生成水,无污染
(2)放 储存在物质内部的能量转化为热能等释放出来放 酸电离出的H+ 与碱电离出的OH- 结合成弱电解质水:H+ +OH- ====H2O
0.20 mol·L-1,则平衡时H2的浓度(mol·L-1)是( )
A.0.16 B.0.08 C.0.04 D.0.02
[解析]选C。据题意,若H2和I2的起始浓度均为 0.20 mol·L-1,达平衡时HI的浓度为0.32 mol·L-1,
则有:
H2(g) + I2(g)  2HI(g)
2HI(g)
起始时(mol·L-1) 0.20 0.20 0
平衡时(mol·L-1) 0.20-0.16 0.20-0.16 0.32
平衡时H2的浓度为0.04 mol·L-1。
有关化学平衡的计算方法
(1)计算模式:设a mol·L-1、b mol·L-1分别为A、B两物质的起始浓度,m x mol·L-1为反应物A的转化浓度,
n x mol·L-1为B的转化浓度,则:
mA(g)+nB(g) pC(g)+qD(g)
c始(mol·L-1) a b 0 0
Δc(mol·L-1) mx nx px qx
c平(mol·L-1) a-mx b-nx px qx
(2)基本步骤:①确定反应物或生成物的起始加入量。
②确定反应过程中各物质的变化量。
③确定平衡时各物质的平衡量。
④依据题干中的条件建立等式关系进行解答。


12.在一定温度下,一定体积的密闭容器中有如下平衡:
H2(g)+I2(g) 2HI(g)
2HI(g)
已知H2和I2的起始浓度均为0.10 mol·L-1,达平衡时HI的浓度为0.16 mol·L-1,若H2和I2的起始浓度均变为
10.(2010·福州高一检测)在下列四种反应条件下,锌和盐酸反应速率最快的是( )
A.20 ℃时,将锌片放入0.01 mol·L-1的稀盐酸中
B.20 ℃时,将锌片放入0.1 mol·L-1的稀盐酸中
C.50 ℃时,将锌片放入0.01 mol·L-1的稀盐酸中
D.50 ℃时,将锌片放入0 .1
mol·L-1的稀盐酸中
.1
mol·L-1的稀盐酸中
[解析]选D。D项中温度最高且稀盐酸浓度最大,因此反应速率最快。

9.化工生产中,为加快反应应优先考虑的措施是( )
A.选用适宜的催化剂
B.采用高压
C.采用高温
D.增大反应物浓度
[解析]选A。虽然上述因素都能加快反应速率,但工业生产中从降低生产成本和提高生产效率的方面考虑,选用适宜的催化剂是优先考虑的措施,催化剂能极大地加快反应速率。
8.如图装置中, U形管内为红墨水,a、b试管内分别盛有 (显中性的)食盐水和(显酸性的)氯化 铵溶液,各加入生铁(含C、Fe)块,a、 b中均能构成原电池而使铁分别被O2和H+ 腐蚀,放置一段时间 。下列有关描述错误
。下列有关描述错误
的是( )
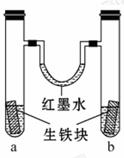
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe-2e- ====Fe2+
D.a试管中O2得电子,b试管中H+ 得电子
[解析]选B。a为中性环境,Fe失电子,O2得电子,氧气被消耗,气体压强减小;b中酸性较强,Fe失电子,H+
得电子,有氢气放出,气体压强 增大,所以红墨水柱两边的液面变为左高右低,故B项错。
增大,所以红墨水柱两边的液面变为左高右低,故B项错。
7.如图所示,在盛有水的烧杯中,铁 圈和银圈的连接处吊着一根绝缘的细 丝,使之平衡,小心地从烧杯中央滴 入硫酸铜溶液。片刻后可观察到的现 象是(指悬吊的金属圈)( )
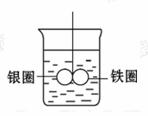
A.铁圈和银圈左右摇摆不定
B.铁圈和银圈仍保持平衡状态不变
C.铁圈向下倾斜,银圈向上倾斜
D.铁圈向上倾斜,银圈向下倾斜
[解析]选D。铁圈和银圈接触,在硫酸铜溶液中构成原电池,铁是原电池的负极,铁圈溶解,质量减小;银是原电池的正极,溶液中的铜离子在正极上被还原,产生单质铜附着在银圈上,质量增加,所以铁圈向上倾斜,银圈向下倾斜。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com