
题目列表(包括答案和解析)
2.下列关于卤化氢的说法中不正确的是( )
A.卤素原子半径越大,氢化物越稳定
B.卤素原子半径越大,氢化物越不稳定
C.卤化氢稳定性为HF>HCl>HBr>HI
D.卤素单质与氢气越难反应,生成物越不稳定
[解析]选A。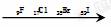
原子的核电荷数:逐渐增大;
原子的半径:逐渐增大;
单质与H2化合的难易度:越来越难;
氢化物的稳定性:越来越弱。
1.(2009·青岛模拟)德贝莱纳用MnO2催化KClO3分解制氧气时发现制得的氧气有异常的气味,使该气体通过KI-淀粉溶液,溶液变蓝,则氧气中可能混有( )
A.Cl2 B.Br2 C.HCl D.CO2
[解析]选A。产生的O2中一定混有能氧化I-的氧化剂,由元素守恒定律知,这种氧化剂绝不可能是Br2,而C、D两物质均不会将I-氧化为I2。
8.(8分)在历史上有很长一段时间,人们一直认为原子是“实心球”,在1911年前后,在新西兰出生的物理学家卢瑟福将一束变速运动的α粒子(质量数为4、中子数为2的+2价离子)射向一片极薄的金箔,他惊奇地发现,由这种“实心球”紧密排列成的金箔,竟被大多数α粒子畅通无阻地通过,就像金箔不存在似的,但也有极少数α粒子发生偏转,或被笔直地弹回。这就是著名的α粒子散射实验。根据以上叙述回答下列问题。
(1)用“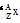 ”的形式写出α粒子的化学式并求其电子数。
”的形式写出α粒子的化学式并求其电子数。
(2)根据α粒子散射实验的实验现象,你能得出关于金原子的哪些结构特点?试写出其中的三点。
①_______________________________________;
②_______________________________________ ;
③_______________________________________ 。
(3)美国发射的航空器将我国研制的磁谱仪带入太空,其目的是探索反物质。反物质的主要特征是电子带正电荷,质子带负电荷。那么反物质酸碱中和反应的离子方程式该如何表示?
[解析](1)这是原子物理中的一个实验,这个实验推翻了原子是一个“实心球”的假设,从而确定了现代原子结构理论。α粒子是质量数为4、中子数为2的+2价离子,
根据质量数、质子数和中子数的关系可求出α粒子的质子
数为2,所以应该是He元素,α粒子的化学式是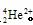 。He
。He
原子的电子数等于其核内质子数(2个),失去2个电子变成He2+后电子数就是0了,所以α粒子不含电子。
(2)根据α粒子散射实验的实验现象:大多数α粒子畅通无阻地通过金箔,只有极少数发生偏转或被笔直地弹回,我们可以推测发生偏转或被笔直地弹回的α粒子肯定
是碰到与其所带电荷电性相同或者不带电的质量相对较大的微粒,因为异性电荷会相互吸引,微粒质量只有远大于α粒子的质量时才有可能将其弹回。所以,这一质量相对较大的微粒很可能就是带正电荷的原子核,其体积非常小,仅占原子体积的很小一部分(只有少数α粒子偏转或反弹),而质量相对非常小的带负电的电子,占了原子的绝大部分体积(多数α粒子通过)。进一步可以推测金原子核的质量远大于α粒子的质量。又因为α粒子没有将金原子的电子带走说明金原子核对电子的吸引能力远大于α粒子,则金原子核所带的正电荷比α粒子多并且集中。
(3)本题涉及的内容具有前沿性,它从另一个角度表达了原子的主要构成微粒及其电性关系。构成反物质的原子称为反原子,反原子与原子的不同之处就是质子和电子所带的电荷性质恰好分别相反,氢原子失去带正电荷的电子形成阴离子H-,氧原子和氢原子各一个构成的原子团获得1个带正电荷的电子形成阳离子OH+,二者之间的反应可表示为H-+OH+====H2O。
答案:(1)α粒子的化学式是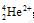 ;电子数是0。
;电子数是0。
(2)①原子中存在原子核和核外电子
②原子核体积小而质量大,带有远大于α粒子的正电荷
③电子的质量小而占有的空间相对非常大,带负电荷(合理即可)
(3)H-+OH+====H2O
7.(11分)(思维拓展题)有A、B、C、D、E 5种短周期元素,A与B可形成BA型化合物,且A元素是卤族元素中非金属性最强的元素;金属B的原子核内质子数比它前一周期同主族元素原子的质子数多8;C元素有3种同位素C1、C2、C3,自然界里含量最多的是C1,C3原子的质量数是C1的3倍,C2原子的质量数是C1的2倍;D的气态氢化物的水溶液呈碱性,而其最高价氧化物对应的水化物为强酸;E元素原子的最外层电子数比次外层电子数多4。
(1)写出下列元素的元素符号:A______,B ______ ,
C ______ ,D ______ ,E ______ 。
(2)写出C1、C2、C33种原子的符号:
C1 ______ ,C2 ______ ,C3 ______ 。
(3)E2-的结构示意图为______ 。
(4)A与B形成的化合物的化学式是______ ,
最常见的E原子与C2形成的分子中含______个中子。
[解析]A是卤素中非金属性最强的元素,则A为F;由B与A形成BA及B的质子数特点可知,B为Na;有3种同位素原子的元素为H;由D的气态氢化物呈碱性及其最高价氧化物对应的水化物呈强酸性可知,D为N;由E的电子排布情况可知,E为O。
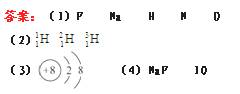
[实验·探究]
5.(2009·深圳高一检测)已知自然界的氧原子有3种:16O、17O、18O,氢原子有1H、2H,从水分子的原子构成来看,自然界的水共有( )
A.2种 B.6种 C.9种 D.12种
[解析]选C。形成的水分子分别为:1H216O、
1H217O、1H218O;2H216O、2H217O、2H218O;1H2H16O、
1H2H17O、1H2H18O,共9种。

3.硼有两种天然同位素10B和11B,硼元素的相对原子质量为10.8,则10B与11B的质量之比为( )
A.1∶4 B.5∶22 C.10∶1 D.1∶1
 ]
]

2.(2009·长沙高一检测)简单原子的原子结构可用如图所示方法形象地表示。
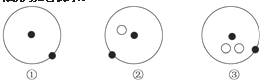
其中“ ”表示质子或电子,“ ”表示中子,则下列关
于①②③的叙述正确的是( )
A.①②③互为同位素
B.①②③互为同素异形体
C.①②③是三种化学性质不同的粒子
D.①②③具有相同的质量数

1.下列叙述错误的是( )
A.13C和12C属于同一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的电子数相等,中子数也相等
[解析]选D。13C和12C是碳元素的两种核素,互称同位素,A正确;1H和2H是氢元素的两种不同核素,它们的质子数都是1,B正确;14C和14N质量数都是14,中子数分别为8和7,C正确;6Li和7Li电子数为3,中子数分别为3和4,D错误。
8.(13分)已知1-20号元素中A、B、C、D四种元素的原子中,质子数为A<B<C<D,A元素的原子最外层电子数是次外层电子数的2倍;B元素的原子核外M层电子数是L层电子数的一半;C元素的原子次外层电子数比最外层电子数多1个。D的原子核外K层、L层电子数之和等于M、N层电子数之和,试推断:
(1)元素的名称:C _________ ,D _________ 。
(2)原子结构示意图:A _________ ,B ________ 。
(3)工业上由A元素的单质制取B元素的单质的化学方程式_________ 。
(4)若没有“质子数为A<B<C<D”的限制,C还可以是
_________元素。
[解析]A元素的原子最外层电子数是次外层电子数的2倍,次外层只能是K层,A为碳元素;B元素的原子核外M层电子数是L层电子数的一半,L层电子数为8,M层电子数为4,B元素为硅元素;C元素的原子次外层电子数比最外层电子数多1个,符合此条件的元素有锂和氯,因为质子数B小于C,C为氯元素;D的原子核外K层、L层电子数之和为10,又等于M、N层电子数之和,D为钙元素。

7.(9分)(2009·南通高一检测)已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X是___(填名称,下同),Y是____ ,Z是____ 。
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是______ 。
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是______和______ 。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为4∶2∶3,该盐的化学式(分子式)是____ 。
[解析](1)根据原子的核外电子排布情况容易得出X为H、Z为O,再根据Y和Z可以形成两种以上气态化合物,原子序数依次递增得出Y只能为N;(2)考查化学式的有关计算;(3)考查10电子微粒的知识;(4)N、H、O三种元素形成的盐只能是铵盐。
答案:(1)氢 氮 氧 (2)N2O5 (3) 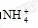 OH-
OH-
(4)NH4NO3
[实验·探究]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com