
题目列表(包括答案和解析)
7.(10分)碱金属氢化物为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,写出其化学反应方程式____________;
MH能与水剧烈反应MH+H2O====MOH+H2↑,MH与液氨也有类似反应,写出反应方程式____________ 。

[实验·探究]
6.(10分)甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA 族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第______周期;乙元素在周期表中位于 第______族;丙元素的名称为_
第______族;丙元素的名称为_ _____
。
_____
。
(2)甲的单质与水反应的离子方程式为______ 。
乙单质与丙单质反应的化学方程式为______ 。

4.在下列所表示的微粒中,氧化性最强的是( )
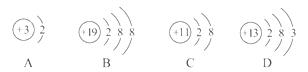
[解析]选A。四个选项的示意图表示的分别是Li+、K+、Na+、Al。“氧化性最强”,即得电子的能力最大。失电子能力为:K>Na>Li,则得电子能力为:Li+>Na+>K+,而D项Al原子只有还原性,所以选A。

3.下列有关碱金属铷(Rb)的叙述中,不正确的是( )
A.Rb2CO3易溶易电离
B.Rb位于周期表第五周期第ⅠA族
C.在钠、钾、铷三种单质中,铷的熔点最高
D.氢氧化铷和盐酸反应的离子方程式是:OH-+H+====H2O
[解析]选C。由Na的化合物的性质可推知Rb的化合物性质,可知A、D正确;根据Rb在周期表中位置可知B正确;C项中钠的熔点最高,C错,所以选C。
2.①钾比水轻;②钾的熔点低;③钾与水反应时要放出热量;④钾与水反应后溶液呈碱性,某学生将一小块金属钾投入滴有酚酞试液的水中,以上实验能证明上述四点性质中的( )
A.①④ B.①②④
C.①③④ D.①②③④
[解析]选D。K与水反应时浮在水面说明钾比水轻,熔成小球说明反应放热且K的熔点低,溶液变红说明反应后溶液呈碱性。
1.(2009·咸阳高一检测)碱金属是典型的活泼金属,其根本原因是( )
A.碱金属单质的密度小,熔点和沸点低
B.碱金属在常温下易被氧化
C.碱金属原子最外电子层上都只有1个电子,容易失去
D.碱金属原子的核电荷数比较小
[解析]选C。结构决定性质,碱金属最外层只有一个电子,易失去,表现出较活泼的金属性。
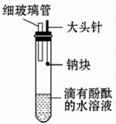
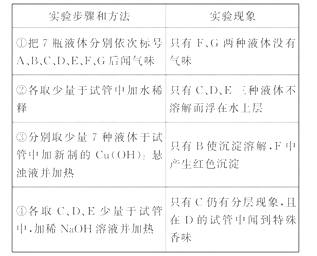
8.(10分)现有7瓶失去了标签的液体,已知它们是有机溶剂,可能是①乙醇 ②乙酸 ③苯 ④乙酸乙酯
⑤油脂 ⑥葡萄糖溶液 ⑦蔗糖溶液。现通过如下实验步骤来确定各试剂瓶中所装的液体名称:
(1)试给它们的试剂瓶重新贴上标签:
A _____ ,B _____ ,C _____ ,D _____ ,
E _____ ,F _____ ,G _____ 。
(2)写出在D中加入NaOH溶液并加热的化学方程式____。
(3)已知乙醛发生银镜反应的方程式为
CH3CHO+2Ag(NH3)2OH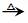 CH3COONH4++H2O+2Ag↓+3NH3
CH3COONH4++H2O+2Ag↓+3NH3
试写出葡萄糖发生银镜反应的方程式为_____。
[解析](1)本题通过实验现象与性质的关系来推断有机物。7种物质中只有葡萄糖溶液和蔗糖溶液无气味;苯、乙酸乙酯、油脂不溶于水且密度比水小;乙酸呈酸性,能与Cu(OH)2发生中和反应,葡萄糖具有还原性,能与新制的Cu(OH)2反应生成红色的Cu2O沉淀。乙酸乙酯、油脂均在稀NaOH溶液中发生水解,而不再有分层现象,乙酸乙酯的水解产物之一乙醇有特殊香味,乙醇易溶于水,苯不溶于水且密度比水小,二者均不与Cu(OH)2和NaOH反应。
(2)乙酸乙酯在NaOH溶液中加热生成乙酸钠和乙醇。
(3)根据葡萄糖的结构简式并结合信息反应即可写出方程式。
答案:(1)A.乙醇 B.乙酸 C.苯 D.乙酸乙酯
E.油脂 F.葡萄糖溶液 G.蔗糖溶液
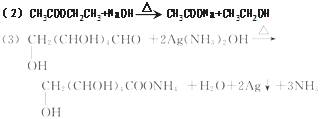
7.(10分)某天然油脂A的分子式为C57H106O6。1 mol该油脂水解可得到1 mol甘油、1 mol不饱和脂肪酸B和2 mol 直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为n(C)∶n(H)∶n(O)=9∶16∶1。
(1)写出B的分子式: _____ 。
(2)写出C的结构简式: _____ 。
(3)写出含5个碳原子的C的同系物的同分异构体的结构简式: _____ 。
[解析]由于B的相对分子质量为280,且n(C)∶n (H)
∶n(O)=9∶16∶1,知B的分子式为C18H32O2。由于甘油分 子中含3个碳原子,故C的碳原子数为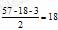 ;又知C为 饱和脂肪酸,故C的分子式为C18H36O2,结构简式为 CH3(CH2)16COOH,它的同系物含有5个碳原子,为C5H10O2,即C4H9-COOH。因丁基(-C4H9)有四种同分异构体,故C4H9COOH有四种同分异构体。
;又知C为 饱和脂肪酸,故C的分子式为C18H36O2,结构简式为 CH3(CH2)16COOH,它的同系物含有5个碳原子,为C5H10O2,即C4H9-COOH。因丁基(-C4H9)有四种同分异构体,故C4H9COOH有四种同分异构体。
答案:(1)C18H32O2 (2)CH3(CH2)16COOH
(3)CH3CH2CH2CH2COOH、
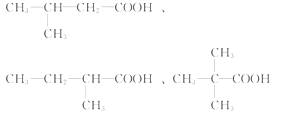
[实验·探究]
6.(10分)大豆含有大量的蛋白质和脂肪,由大豆配制出来的菜肴很多,它是人体营养中最重要的补品之一,我们几乎每天都要饮食豆制品。请回答下列问题:
(1)我们所吃的豆腐是一种_____ 。
A.蛋白质凝胶 B.纯蛋白质
C.脂肪 D.淀粉
(2)我们食用的大豆,最终补充给人体的主要成分___ 。
A.氨基酸 B.蛋白质 C.油脂 D.糖类
(3)天然蛋白质水解的最终产物是_____ 。请以甘氨酸(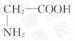 )为例,写出其与NaOH反应的化学方程式 _____ 。
)为例,写出其与NaOH反应的化学方程式 _____ 。
(4)豆油不能保存较长时间的原因主要是_______ ,所以必须进行硬化,油脂的硬化就是指_________ ,人造脂肪指的是_________ 。
[解析]在豆浆中加入少量的石膏,能使豆浆凝结成豆腐,所以豆腐是一种蛋白质凝胶,它在人体内作用最终补充给人体的是氨基酸,故(1)中A正确。
(2)中A正确;
(3)天然蛋白质水解的最终产物是α- 氨基酸。据甘氨酸的结构简式可写出它与NaOH反应的化学方程式为 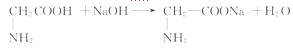
(4)因豆油中含有碳碳双键,所以易被空气中O2氧化而变质,而油脂氢化就是指对易氧化的不饱和脂肪酸甘油酯进行催化氢化,所得的产物即为硬化油,也叫人造脂肪。
答案:(1)A (2)A
(3)α- 氨基酸
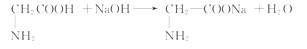
(4)分子中含有碳碳双键易被空气中O2氧化 对易氧化的不饱和脂肪酸甘油酯进行催化加氢 经氢化后的饱和的高级脂肪酸的甘油酯
5.下列叙述不正确的是( )
A.天然气和沼气的主要成分是甲烷
B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
C.纤维素乙酸酯、油脂和蛋白质在一定条件下都能水解
D.葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
[解析]选B。天然气、煤道坑气和沼气的主要成分都是甲烷,故A正确;因为是等物质的量的乙醇和乙酸,再根据乙醇和乙酸分子式可知B错;纤维素乙酸酯、油脂和蛋白质都能在一定条件下水解,C正确;葡萄糖属于单糖,分子式为C6H12O6,蔗糖属于糖类中的二糖,分子式为C12H22O11,按照同系物的定义可知,D正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com