
题目列表(包括答案和解析)
2.将5.6 g铁粉投入盛有100 mL 2 mol/L稀硫酸的烧杯中,2 min时铁粉刚好溶解完全。如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )
A.v(Fe)=0.5 mol/(L·min)
B.v(H2SO4)=1 mol/(L·min)
C.v(H2)=0.5 mol/(L·min)
D.v(FeSO4)=0.5 mol/(L·min)
[解析]选D。铁粉是固体,浓度视为常数,A项错;铁粉完全反应,硫酸不一定完全反应,B项错;
Fe+H2SO4====FeSO4+H2↑,氢气逸出,不在溶液中,C项错;硫酸亚铁浓度增大,2 min时,其浓度为1mol/L,
v(FeSO4)=0.1mol/(0.1L×2min)=0.5mol/(L·min)。
1.(2010·连云港高一检测)盐酸与块状CaCO3反应时,不能使反应最初的速率明显加快的是( )
A.将盐酸的用量增加一倍
B.盐酸的浓度增加一倍,用量减半
C.温度升高30 ℃
D.改用更小块的CaCO3
[解析]选A。盐酸的浓度影响反应速率而非用量,A项不能提高反应速率而B项能;温度升高,速率加快;用小块CaCO3可增大反应时接触面积,反应速率增大,故选A。
716.8 L/22.4 L·mol-1+8 mol=40 mol。原混合气体与平衡混合气体总物质的量之比为40∶32=5∶4。
(4)前面已经计算出来原混合气体中a=16,所以H2的物质的量b=40-16=24
所以a∶b=16∶24=2∶3。
(5) N2 + 3H2  2NH3
2NH3
开始 16 24 0
转化 4  12 8
12 8
平衡 12 12 8
N2、H2的转化率之比为α(N2)∶α(H2)= ∶ =1∶2。
答案:(1)16 (2)8 mol
(3)5∶4 (4)2∶3 (5)1∶2
716.8 L/22.4 L·mol-1)×25%=8 mol。
( 3)可利用差量法计算:假设气体总物质的量减少y,
3)可利用差量法计算:假设气体总物质的量减少y,
N2+3H2  2NH3 Δn
2NH3 Δn
1 3 2 2
8 mol y
解得y=8 mol
所以原混合气体的总的物质的量为
8.(14分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,n(N2)=13 mol,n(NH3)=
6 mol,计算a的值。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n始∶n平=_____。
(4)原混合气体中,a∶b=_____。
( 5)达到平衡时,N2和H2的转化率之比,α(N2)∶
5)达到平衡时,N2和H2的转化率之比,α(N2)∶
α(H2)=_____。
[解析](1)由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,
设反应掉的N2的物质的量为x mol,则x∶6=1∶2
解之x=3 则a=13+3=16
(2)平衡时NH3的物质的量为
7.(8分)作为国家正在实施的“西气东输工程终点站,上海将逐步改变以煤、石油为主的能源结构,这对解决城市环境污染意义重大。”目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为燃料。管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4。它们的燃烧反应如下:
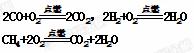
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是_____。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是_____(填“增大”或“减小”)进风口,如不作改进可能产生的不良结果是_____,管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见表。
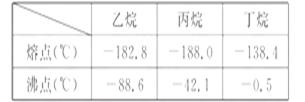
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是_____ 。
[解析]根据化学方程式,2体积CO或H2燃烧时只需1体积 O2,而1体积CH4燃烧时需2体积O2,故管道煤气的灶具改烧天然气时,要增大进风口,若O2量不足,会使燃料燃烧不充分而产生CO污染空气。根据表中数据丁烷沸点为
-0.5 ℃,冬天时易凝结为液体。
答案:天然气 增大 不能充分燃烧(生成有毒的CO) 丁烷遇冷凝结为液体使管内气流不畅
[实验·探究]
6.(8分)(2008·上海单科改造题)在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中, n(NO)随时间的变化如表:
2NO2(g)体系中, n(NO)随时间的变化如表:

(1)上述反应_____ (填“是”或“不是”)可逆反应,在第5 s时,NO的转化率为_____ 。
 (2)如图中表示NO2变化曲线的是 _____ 。用O2表示从0 s-2 s内
(2)如图中表示NO2变化曲线的是 _____ 。用O2表示从0 s-2 s内
该反应的平均速率v= _____ 。
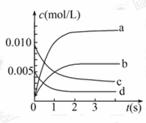
(3)能说明该反应已达到平衡状态 的是_____ 。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变

(3)a项中未指明正、逆反应速率,故无法说明该反应是否达到平衡状态;由于该反应是前后气体体积不相等的反应,当容器内压强保持不变时,说明该反应已达到平衡状态,故b项正确;c项中已说明正、逆反应速率相等,故说明该反应已达到平衡状态;由于气体总质量不变,气体总体积也不变,因此,无论该反应是否达到平衡,容器内密度总保持不变,故d项无法说明该反应是否达到平衡状态。
答案:(1)是 65%
(2)b 1.5×10-3 mol/(L·s) (3)b、c
5.下列关于化学反应限度的叙述错误的是( )
A.不同的化学反应,限度可能不同
B.可以通过改变反应物浓度来控制化学反应的限度
C.可以通过延长化学反应的时间来改变反应的限度
D.催化剂不能控制化学反应的限度
[解析]选C。不同化学反应,限度可能不同,A正确;可通过改变反应物浓度控制化学反应限度,但不能用催化剂来控制反应限度,因为催化剂只能同等程度地改变正、逆化学反应速率,B、D均正确;反应时间无法改变反应限度,C错误,故选C。
0.15 mol·L-1。故选B、D。
4.(多选)(思维拓展题)可逆反应N2(g)+3H2(g)
 2NH3(g),500 ℃时,将2 mol N2和2.25 mol H2充入容积为10 L的密闭恒容容器中进行反应,则达到平衡时,NH3的浓度不可能达到的值是( )
2NH3(g),500 ℃时,将2 mol N2和2.25 mol H2充入容积为10 L的密闭恒容容器中进行反应,则达到平衡时,NH3的浓度不可能达到的值是( )
A.0.1 mol·L-1
B.0.2 mol·L-1
C.0.05 mol·L-1
D.0.15 mol·L-1
[解析]选B、D。该题中N2过量,假设2.25 mol H2完全反应,生成NH3的浓度为0.15 mol·L-1,但该反应是可逆反应,H2不可能完全生成NH3,故NH3的浓度小于
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com