
题目列表(包括答案和解析)
7.(12分)A、B、C、D、E五种短周期元素的原子序数依次增大,A、B同周期,A、C同主族,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体。又已知C、E的单质均可溶于NaOH溶液,且C与NaOH溶液反应可产生气体。
(1)写出A、B、C、D、E五种元素的名称。
A ______ ,B ______ ,C ______ ,D ______ ,
E ______ 。
(2)写出DB2使澄清石灰水变浑浊的化学方程式。
__________________________ _________________ 。
_________________ 。
(3)写出C、E的单质分别与NaOH溶液反应的离子方程式___________________,______________________ 。

[实验·探究]
6.(8分)(2009·启东高一检测)元素A的原子序数为x,A和B所在的周期的元素种类数分别是m和n。
( 1)如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为______,当B在A的下一周期时,B的原子序数为______ 。
1)如果A和B同在ⅠA族,当B在A的上一周期时,B的原子序数为______,当B在A的下一周期时,B的原子序数为______ 。
(2)如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为______ ,当B在A的下一周期时,B的原子序数为______ 。
[解析](1)A、B都在Ⅰ A族时,两元素的原子序数之差为上面元素所在周期中包含的元素种类数;
A族时,两元素的原子序数之差为上面元素所在周期中包含的元素种类数;
(2)A、B若都在ⅦA族时,两元素的原子序数之差为下面元素所在周期中包含的元素的种类数。
答案:(1)x-n x+m (2)x-m x+n
5.(多选)(思维拓展题)6 g某金属跟足量盐酸反应产生0.5 g氢气,生成的+2价金属氯化物中共有11.5 mol电子,则该金属在元素周期表中的位置是( )
A.第二周期 B.第三周期 C.ⅡA族 D.ⅢA族
[解析]选B、C。设该金属为M,
则M+2HCl====MCl2 + H2↑
n(M) n(MCl2) 0.5 g/2 g·mol-1
n(MCl2)=0.25mol,设M原子电子数为x,
(x+17×2)×0.25=11.5 ,解得x=12,原子中电子数=质子数=12,故该金属为Mg。
4.(2009·西安模拟)元素周期表中相邻元素之间原子序数的关系正确的是( )
A.相邻主族的元素的原子序数之差一定都是1
B.主族中相邻元素的原子序数之差只有1、11、25
C.相邻周期元素的原子序数之差一定都是8
D.相邻周期元素的原子序数之差可能有2、8、18、32
[解析]选D。分析元素周期表可知,相邻主族元素的原子序数之差有1、11、25;相邻周期元素的原子序数之差有2、8、18、32。
3.(2009·喀什高一检测)下图是元素周期表中的一部分,图中数字为原子序数,其中M的原子序数为37的是( )

[解析]选B。A项M的原子序数为36;C项中M的原子序数为45;D项中M的原子序数为38。
2.(多选)若把长式元素周期表原先的主副族及族号取消,由左至右改为18列,如碱金属元素在第1列,稀有气体元素在第18列。按此规定,下列说法错误的是( )
A.第9列元素中没有非金属元素
B.只有第2列元素原子最外层有2个电子
C.第1列元素均为金属元素
D.在整个18列元素中,第3列的元素种类最多
[解析]选B、C。根据元素周期表的结构可知,第9列是原第Ⅷ 族中的第2个纵行,没有非金属元素,A项正确。第18列的He元素最外层也有2个电子,所以B项错误。第1列元素除了碱金属元素外还有氢,而氢为非金属元素,因此C项错误。第3列即第ⅢB族,包括镧系
族中的第2个纵行,没有非金属元素,A项正确。第18列的He元素最外层也有2个电子,所以B项错误。第1列元素除了碱金属元素外还有氢,而氢为非金属元素,因此C项错误。第3列即第ⅢB族,包括镧系 和锕系元素,镧系和锕系各包括15种元素,因此第3列元素种类最多,D项正确。
和锕系元素,镧系和锕系各包括15种元素,因此第3列元素种类最多,D项正确。
1.美国FDA证实,该国地质勘测局在内华达州法隆镇的一些奶牛场附近的井水中发现了84号元素Po(钋)的一种放射性致癌同位素。钋是目前已知最稀有的元素之一,下列有关它的说法正确的是( )
A.门捷列夫能预测钋在地球上的分布
B.钋在第七周期第ⅥA族
C.钋的最外层电子数为6
D.钋属于副族元素
[解析]选C。A项,门捷列夫发现了元素周期律,但不能预测元素在地球上的分布,所以错误;因为钋和86号元素的原子序数之差为2且小于86,所以钋在第六周期第ⅥA族,最外层电子数应为6个,所以C正确,B、D错误。
8.(14分)某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
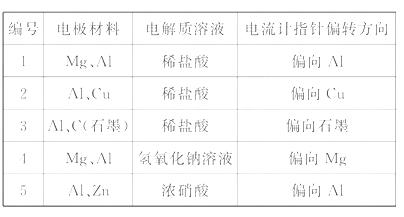
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极) _____ (填“相同”或“不相同”)。
(2)对实验3完成下列填空:
①铝为_____极,电极反应式: _____ ;
②石墨为_____极,电极反应式: _____ ;
③电池总反应式: _____ 。
(3)实验4中铝作_____ ,理由是______________。写出铝电极的电极反应式: _____ 。
(4)解释实验5中电流计指针偏向铝的原因_______。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素_____。
[解析]在稀盐酸中Mg比Al活泼,Mg作原电池的负极,Al作原电池的正极,电流计指针偏向Al;在稀盐酸中Al比Cu活泼,Al作原电池的负极,Cu作原电池的正极,电流计指针偏向Cu。由此可知,在这里的原电池中电流计指针是偏向于正极。在实验3中电流计指针偏向石墨,由上述规律可知,在该原电池中铝作负极,石墨作正极。化学反应是铝失去电子被氧化为铝离子,盐酸中的氢离子得到电子被还原为氢气。在氢氧化钠溶液中Al能与NaOH发生氧化还原反应而Mg不能与NaOH反应,所以Al作原电池的负极,Mg作原电池的正极。铝在浓硝酸中钝化,锌在浓硝酸中被氧
化,即在浓硝酸中Zn比Al活泼,Zn作原电池的负极,Al作原电池的正极,所以在实验5中电流计指针偏向铝。该实验的设计运用比较法探究铝电极在原电池中的作用。实验1、2、3是电解质溶液相同,电极材料不同;实验1和4比较的是电极材料相同,电解质溶液不同;实验5与其他实验比较的是电极材料和电解质溶液都不同。这些结果都是总结出影响铝在原电池中作正极或负极的因素。
答案:(1)不相同 (2)① 负 2Al-6e- ====2Al3+② 正 6H+ +6e- ====3H2↑③2Al+6HCl====2AlCl3+3H2↑
(3)负极 铝可与氢氧化钠溶液发生氧化还原反应,而
镁不与氢氧化钠溶液发生化学反应Al-3e-
+4OH-
==== 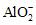
+2H2O(4)铝在浓硝酸中钝化,锌在浓硝酸中被氧化,即在浓硝酸中Zn比Al活泼,Zn作原电池的负极,Al作原电池的正极,所以电流计指针偏向铝(5)①另一个电极材料的活泼性;②铝电极与电解质溶液 能否发生自发的氧化还原反应
能否发生自发的氧化还原反应
7.(10分)氢氧燃料 电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能 力强,性质稳定,
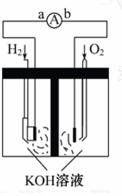
请回答:
(1)氢氧燃料电池的能量转化主要形
式是_____ ,在导线中电子流动方向
为_____ (用a、b表示)。
(2)负极反应式为_____ 。
(3)电极表面镀铂粉的原因为_____ 。
|
Ⅰ.2Li+H2====2LiH Ⅱ.LiH+H2O====LiOH+H2↑
①反应Ⅰ中的还原剂是_____ ,反应Ⅱ中的氧化剂是_____ 。
②已知LiH固体密度为0.82 g/cm3。用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为____ 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为__ mol。
[解析]本题考查电化学知识。(1)原电池的实质为化学能转化成电能。总反应为2H2+O2====2H2O,其中H2从零价升至+1价,失去电子,即电子从a流向b。(2)负极为失去电子的一极,即H2失电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-。(3)铂粉的接触面积大,可以加快反应速率。(4)Ⅰ.Li从零价升至+1价,作还原剂。Ⅱ.H2O的H从+1降至H2中的零价,作氧化剂。由反应Ⅰ,当吸收10 mol H2时,则生成20 mol LiH,V=m/ρ=20×7.9/0.82×10-3(L)=192.68×10-3(L)。
V(LiH)/V(H2)=192.68×10-3 L/224 L=8.6×10-4。
20 mol LiH可生成20 mol H2,实际参加反应的H2为20×80%=16 mol,1 mol H2转化成1 mol H2O,转移2 mol电子,所以16 mol H2可转移32 mol的电子。
答案:(1)由化学能转变为电能 由a到b
(2)2H2+4OH--4e- ====4H2O或H2+2OH--2e- ====2H2O
(3)增大电极单位面积吸附H2、O2的分子数,加快电极反应速率 (4)①Li H2O ②8.6×10-4 ③32
[实验·探究]
6.(6分)(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:_____ ;
银片上发生的电极反应:_____ 。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,则:产生氢气的体积(标准状况)为_____ 。
[解析](1)由锌片、银片和稀H2SO4组成的原电池中很显然锌片为负极,电极反应式为Zn-2e- ====Zn2+;银片为正极,电极反应式为2H+ +2e- ====H2↑。
(2)两电极的总质量为60 g,工作一段时间后,取出洗净干燥称重为47 g,说明锌片反应掉13 g,根据总反应式可知消耗的Zn和产生的H2的物质的量之比为1∶1。
V(H2)= 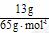 ×22.4 L·mol-1=4.48 L
×22.4 L·mol-1=4.48 L
答案:(1)Zn-2e- ====Zn2+
2H+ +2e- ====H2↑
(2)4.48 L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com