
题目列表(包括答案和解析)
8. 氢气在氯气中燃烧时产生苍白色火焰。在反应过程中, 破坏1 mol 氢气中的化学键消耗的能量为Q1 kJ, 破坏
1 mol 氯气中的化学键消耗的能量为Q2 kJ, 形成1 mol 氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中, 正确的是( )
A. Q1+Q2>Q3 B. Q1+Q2>2Q3
|
[解析]选D。氢气在氯气中燃烧: Cl2+H2 ====2HCl, 该反应放出热量, 即反应中形成化学键所释放的能量大于断裂化学键所吸收的能量。在反应中, 要破坏1 mol H-H键、1 mol Cl-Cl键, 形成2 mol H-Cl键, 所以2Q3-(Q1+Q2)>0, 即Q1+Q2<2Q3。
7. 下列每组物质中含有的化学键类型相同的是( )
A. NaCl、HCl、H2O、NaOH
B. Cl2、Na2S、HCl、SO2
C. HBr、CO2、H2O、CS2
D. Na2O2、H2O2、H2O、O3
[解析]选C。解此类题目的关键在于弄清各类化学键的形成本质。离子键是由阴、阳离子相互作用形成的, 非极性键是由同种元素原子形成的共价键, 极性键是由不同种元素原子形成的共价键。A项中NaCl与NaOH中含有离子键, 而HCl和H2O中只有共价键, NaOH中也含有共价键; B项Cl2、HCl、SO2中只含有共价键, 而Na2S中只含离子键; 而C项中均含有共价键; D项中Na2O2含离子键、共价键, H2O2、H2O、O3中只含共价键, 故C项正确。
6. (2009·山东高考)2SO2(g)+O2(g)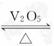 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 增大反应体系的压强反应速率一定增大
C. 该反应是放热反应, 降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻, SO3(g)的浓度分别是c1,
c2,
则时间间隔t1-t2内, SO3(g)生成的平均速率为u= 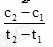
[解析]选D。加入催化剂同时改变正、逆反应速率, A项错误; 若是恒容条件, 增加不参与反应的气体而使反应体系的压强增大, 由于浓度不变, 反应速率就不变, B项错误; 降低温度使反应速率降低, 将增大反应达到平衡的时间, C项错误; 根据计算平均速率的定义公式可得D项正 确。
确。
5. (2010·连云港高一检测)下列化合物中, 阴离子半径和阳离子半 径之比最大的是(
)
径之比最大的是(
)
A. LiI B. NaBr C. KCl D. CsF
[解析]选A。第ⅦA族元素阴离子半径大小顺序是I->Br->Cl->F-, 第ⅠA族元素阳离子半径大小顺序是Cs+>K+>Na+>Li+, 故阴离子半径和阳离子半径之比最大的是LiI。
4. 具有下列结构的原子, 其元素一定属于ⅡA族元素的是( )
A. 最外层电子数与次外层电子数 相等的原子
相等的原子
B. M层电子数为K层电子数一半的原子
C. 最外层有2个电子的原子
D. M层电子数等于其内层电子数之和1/5的原子
[解析]选D。解题时应根据原子的核外电子排布规律, 推断出具体的元素在周期表中的位置, 再进行判断。A中最外层电子数可能是2, 也可能是8, 所以A错; K层电子数的一半为1, 所以肯定不在ⅡA族; 最外层有2个电子的原子可以是He也可以是过渡元素, 所以也不一定在ⅡA族; D中原子的内层电子数为10, 则M层电子数为2, 即为12号元素Mg, 属于ⅡA族, 所以D正确。
3. 钾的金属活动性比钠强, 根本原因是( )
A. 钾的密度比钠的小
B. 钾原子的电子层比钠原子多一层
C. 钾与水反应比钠与水反应更剧烈
D. 加热时, 钾比钠更易汽化
[解析]选B。金属活动性属于化学性质, 化学性质决定于(原子)结构。钾有4个电子层, 而Na只有3个电子层; 最外层电子数相等, 原子核对外层电子的引力K
2. 若短周期中的两种元素可以形成X2Y3型分子, 则这两种元素的原子序数之差不可能是( )
A. 1 B. 3 C. 5 D. 6
[解析]选D。由化合物X2Y3可推知X、Y的价态分别为+3, -2价, X可能为B或Al; Y可能为O或S, 对应的化合物为B2O3、Al2O3、B2S3、Al2S3, 原子序数的差值分别为3、5、11、3; 还有N2O3, 其原子序数之差为1, 不可能是6。
1. (2010·徐州高一检测)月球的土壤中含有丰富的可控核聚变燃料3He, 月海玄武岩中蕴藏着丰富的钛、铁、铬、镍、钠、镁、硅、铜等金属矿产资源和大量的二氧化硅、硫化物等, 将为人类社会的可持续发展作出贡献。下列有关叙述 正确的是(
)
正确的是(
)
A. 月球上的二氧化硅所含元素都是第三周期元素
B. 3He可发生核聚变反应, 这是一种化学变化
C. 月球上的3He是一种新元素
D. 月球和地球上的钛、铁、铬、镍等原子应该具有相同的核外电子排布
[解析]选D。SiO2中氧元素在第二周期, A错; 核聚变反应会改变元素种类, 不是化学变化, B错; 3He是He元素的一种核素, 而不是新元素, C错; 月球上的元素原子核外电子排布和地球上的完全一样, D正确。
13.常饮用矿泉水可以补充某些微量元素,改善人体机能。但某些不法商贩以普通自来水冒充矿泉水出售,严重损害了消费者的利益。
已知自来水常用Cl2进行消毒,Cl2通入水中会与水发生以下反应:Cl2+H2O====HCl+HClO 2HClO 2HCl+O2↑,你如何运用学习过的化学知识,通过简单的实验操作,鉴别你手中的矿泉水是真品还是由自来水假冒的?
2HCl+O2↑,你如何运用学习过的化学知识,通过简单的实验操作,鉴别你手中的矿泉水是真品还是由自来水假冒的?
思路解析:①回顾所学化学知识,分析题给信息;②制订研究方案:③市场抽样;④实验研究;⑤形成报告。
答案:略
12.实验室中要除去细碎铜屑中的少量细碎铁屑,某同学设计了两个方案:
(1)Cu、Fe 过滤
过滤 洗涤
洗涤
(2)Cu、Fe 过滤
过滤 洗涤
洗涤
两个方案较好的是_______________(填序号),理由是______________________________。你是否有简便的方法,若有,请写出做法: __________________________________________。
思路解析:本题考查对实验方案优缺点的分析、评判能力,这是创造更佳方案的基础。题给的两种方案都可以去掉铁屑杂质,方案(1)消耗了盐酸去掉了铁;方案(2)去除了铁,同时增加了主产品铜,故(2)好一些,但不足之处是消耗了CuSO4,产生了FeSO4废液。两方案各有不足,若能用铁的物理性质除去铁,则方法简便又经济。
答案:(2) 去除铁而增加了铜 用磁铁吸取铁屑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com