
题目列表(包括答案和解析)
18. (4分)T ℃时, 向10 L的密闭容器中同时充入6 mol H2和2 mol N2,
2 min末测得生成NH3 1. 2 mol, 前2 min内用N2表示的平均反应 速率是______, N2的转化率是___________________________________________,
H2的转化率是_________________。
速率是______, N2的转化率是___________________________________________,
H2的转化率是_________________。

17. (9分)现有如下两个反应:
(A)NaOH+HCl==== NaCl + H2O
(B)2FeCl3+Cu ==== 2FeCl2+CuCl2
(1)根据两反应本质, 判断能否设计成原电池______。
(2)如果不能, 说明其原因_ ____________________。
____________________。
(3)如果可以, 则写出正、负极材料及其电极反应式, 电解质溶液名称_______________________________
___________________________________________。
[解析]原电池反应原理是氧化还原反应, 发生电子转移, 而中和反应为非氧化还原反应, 故不能设计为原电池, 反应2FeCl3+Cu ==== 2FeCl2+CuCl2可以设计成原电池, Cu失电子被氧化, 为负极, 电解质溶液为FeCl3溶液, 正极材料可以使用C或Pt。
答案: (1)(A)不能, (B)可以
(2)(A)的反应为非氧化还原反应, 没有电子转移
(3)负极: 铜, Cu-2e- ==== Cu2+,
正极: 碳棒, 2Fe3+ +2e- ==== 2Fe2+,
电解质溶液: 氯化铁溶液
16.(9分)氢元素的原子结构特殊, 目前学术界对它在周期表中的位置仍存在争议。
(1)现行元素周期表, 将氢元素排在第_____族, 依据是______________________________________。
(2)目前已制取了金属氢化物, 如NaH、KH、CaH2等, 其中氢元素显______价, 所以有人认为氢元素也可以排在第_______族, 依据是___________________________。
(3)根据活泼金属氢化物已制取的事实, 有人根据氢元素正、负化合价特点, 认为氢还可以排在第_____族, 依据是________________________________________。
(4)人们普通倾向于采用现行教材中“元素周期表”排列方式, 你认为其理由是_______________________。
[解析]元素周期表中同主族元素及其化合物结构和化学性质相似。根据氢原子结构和性质确定氢元素在周期表中的 位置。(1)氢原子核外只有1个电子, 与碱金属元素原子最外层电子数相同, 氢元素在绝大多数化合物中显+1价, 与碱金属元素在化合物中显+1价相似, 所以, 现行元素周期表将氢排在第ⅠA族, 所以, 碱金属位于第ⅠA族, 但不能说位于第ⅠA族的元素都是碱金属。(2)在金属氢化物中, 钠、钾、钙元素都显正化合价, 所以氢元素显-1价, 与金属卤化物中卤族元素化合价相同, 所以, 氢元素也可以排在第ⅦA族。
位置。(1)氢原子核外只有1个电子, 与碱金属元素原子最外层电子数相同, 氢元素在绝大多数化合物中显+1价, 与碱金属元素在化合物中显+1价相似, 所以, 现行元素周期表将氢排在第ⅠA族, 所以, 碱金属位于第ⅠA族, 但不能说位于第ⅠA族的元素都是碱金属。(2)在金属氢化物中, 钠、钾、钙元素都显正化合价, 所以氢元素显-1价, 与金属卤化物中卤族元素化合价相同, 所以, 氢元素也可以排在第ⅦA族。
(3)氢元素有+1价和-1价, 其正化合价与负化合价绝对值相等, 类似于CH4、SiH4中碳、硅元素有+4价(最高化合价)、-4价(最低化合价), 且其绝对值相等, 所以, 有人认为氢还可以排在第ⅣA族。(4)元素周期表首先要具有科学性, 其次考虑美观、对称等审美因素。如果将氢排在第ⅣA族, 显得孤单, 排在第ⅦA族, 显得不对称, 且氢在化合物中主要表现+1价, 综合考虑上述因素, 现行元素周期表将氢元素排在第ⅠA族。
答案: (1)ⅠA 氢原子核外只有1个电子, 在绝大多数化合物中氢显+1价, 与碱金属原子结构和化合价相似(2)-1 ⅦA 氢原子得到1个电子达到稳定结构, 与卤素原子相似 (3)ⅣA 氢元素最高化合价与最低化合价绝对值相等, 与第ⅣA族碳、硅元素的“最高正化合价与最低负化合价绝对值相等”相似
(4)排在第ⅠA族, 元素周期表显得对称、美观, 且氢在绝大多数化合物中显+1价
15. 对于可逆反应2SO2+O2  2SO3,
在混合气体中充
2SO3,
在混合气体中充
入一定量的18O2, 足够长的时间后, 18O原子( )
A. 只存在于O2中
B. 只存在于O2和S O3中
O3中
C. 只存在于O2和SO2中
D. 存在于S O2、O2和SO3中
O2、O2和SO3中
[解析]选D。该反应为可逆反应, 加入18O2后, 它与SO2反应生成SO3, 因此SO3中会有18O原子, 含有18O原子的SO3会部分分解为SO2和O2, 18O原子可能进入O2中, 也可能进入SO2中, 因此最后SO2、O2和SO3中都会有18O原子。
第Ⅱ卷(非选择题 共55分)
14. (多选)将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。在每次实验时, 记录电压表指针的偏转方向和电压表的读数如表所示:
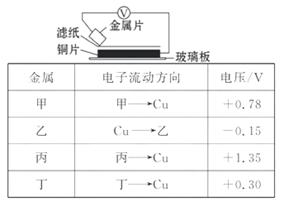
请依据记录数据判断, 下列有关说法正确的是( )
A. 在四种金属中丙的还原性最强
B. 金属乙能从硫酸铜溶液中置换出铜
C. 甲、乙若形成原电池时, 甲为正极
D. 甲、乙形成合金时, 将该合金露置在空气中, 甲先被腐蚀
[解析]选A、D。两种金属作电极构成原电池时, 所产生的电压越大, 说明两金属的活动性相差越大, 所以甲、丙、丁三种金属相比较: 丙最活泼、甲次之、丁第三, 乙中电压表与其他三项偏转方向相反, 说明乙的活泼性比铜差。
13. 某同学按如图所示的装置做实验,并把实验情况记录于下面, 其中叙述
合理的是( )
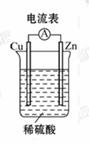
①锌为正极, 铜为负极
②电解质溶液的pH不变
③电流表 的指针发生偏转
的指针发生偏转
④铜极上有气泡产生
⑤锌极上仍有少量气泡产生
⑥溶液中的阳离子向负极移动
A. ①②③ B. ③④⑤ C. ③④⑥ D. ②③④
[解析]选B。Zn的活泼性大于Cu, 锌作负极, 铜作正极, ①错; 反应过程中消耗H+, pH增大, ②错; 电流表中有电流通过, 指针偏转, ③正确; 铜为正极, 铜极上生成H2, ④正确; ⑤Zn和杂质构成微型原电池, 也会看到Zn极上有少量气泡, ⑤正确; ⑥阳离子应向正极移动, ⑥错, 故选B。
12. 近来, 科学家研制了一种新型的乙醇电池(DEFC), 它用磺酸类质子作溶剂, 在200℃左右时供电, 乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为: C2H5OH+3O2
 2CO2+3H2O。
2CO2+3H2O。
下列说法不正确的是( )
A. C2H5OH在电池的负极上参加反应
B. 1 mol乙醇被氧化转移6 mol电子
C. 在外电路中电子由负极沿导线流向正极
D. 电池正极得电子的物质是O2
[解析]选B。由原电池反应的原理, 原电池中负极发生氧化反应, 正极发生还原反应, 乙醇在反应中被氧化, 发生氧化反应, 则表明乙醇在负极上发生反应, 故A项正确; B项中, 由电池的总反应式可知, 1 mol乙醇被氧化, 同时有3 mol O2被还原, 则转移的电子为3 mol×4=12 mol, 故B项不正确; 外电路中电子流向和电流流向相反, 即从负极流向正极, 所以C项正确; 在正极上发生反应的物质是O2, O2得电子, 所以D项正确。
11. 某温度下, 在一固定容积的容器中进行反应H2(g)+I2(g) 2HI(g), 下列情况一定能说明反应已达到平衡状态的是(
)
2HI(g), 下列情况一定能说明反应已达到平衡状态的是(
)
A.  压强不再随时间而改变时
压强不再随时间而改变时
B. 气体的总质量不再改变时
C. 混合气体中各组成成分的含量不再改变时
D. 单位时间内每消耗1 mol I2, 同时有2 mol HI生成时
[解析]选C。判断一反应是否达到平衡状态, 从宏观上看各种成分的量是否再发生改变, 从微观上看正、逆反应速率是否相等。因为此反应中各成分均为气体且反应前后气体的物质的量相等, 所以无论是否达到平衡, 压强和质量都不发生改变, 故A、B两项不正确。消耗I2与生成HI的方向均为正反应方向, D项不能证明正反应速率与逆反应速率相等, 故D不正确。
10.(2009·武汉高一检测)向四个体积相同的密闭容器
中分别充入一定量的SO2和O2, 开始反应时, 按正反应速率
由大到小的顺序排列, 正确的是( )
①500 ℃, 10 mol SO2和5 mol O2反应
②500 ℃, 用V2O5作催化剂, 10 mol SO2和5 mol O2反应;
③450 ℃, 8 mol SO2和5 mol O2反应
④500 ℃, 8 mol SO2和5 mol O2反应。
①②③④ B.②①③④
C.②①④③ D.④③②①
[解析]选C。本题主要考查影响化学反应速率的因素, 所涉及的影响因素为浓度、温度和催化剂。反应速率最快的一定是有催化剂的②; ③和④比较当然是500℃时比
450℃时快, 故反应速率由大到小的顺序为: ②①④③。
9. 将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧, 这样处理的目的是( )
①使煤充分燃烧, 提高煤的利用率
②减少SO2的产生,  避免造成“酸雨”
避免造成“酸雨”
③减少有毒的CO产生, 避免污染空气
④减少CO2的产生, 避免“温室效应”
A. ①②③ B. ②③④ C. ①③④ D. ①②③④
[解析]选A。煤块粉碎是为了燃烧更充分, 提高利用率, 减少CO的产生, 但不能减少CO2的产生, 脱硫处理是为了减少SO2的产生, 避免造成“酸雨”。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com