
题目列表(包括答案和解析)
7.下列说法正确的是( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直 接加热法和电解法冶炼得到
接加热法和电解法冶炼得到
D.天然气、沼气和水煤气分别属于化石能源、不可再生能源和二次能源
[解析]选B。A项中纯碱应为盐,不是碱;C项中Mg、Al应用电解法冶炼,Cu用热还原法冶炼;D项中沼气属于可再生能源。
6.下列物质中,既有离子键,又有共价键的是( )
A.CaCl2 B.KOH C. H2O D.N2
H2O D.N2
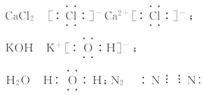 [解析]选B。这四种物质的电子式分别为:
[解析]选B。这四种物质的电子式分别为:
,故只有KOH中既有
离子键,又有共价键。
5.已知A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2- 和C-,B2+ 和C- 具有相同的电子层结构,下列说法正确的是( )
A.C元素的最高正价为+7价
B.离子半径:A2->C->B2+
C.对应气态氢化物的稳定性:A>C
D.还原性:A2-<C-
[解析]选B。因A、B、C均为短周期元素,又因为B2+
与C- 具有相同电子层结构且A、C最低价分别为-2、-1价,故 B为Mg、C为F,A为S。F无正价,A错误;离子半径:S2->F->Mg2+,B正确;气态氢化物的稳定性:H2S<HF,C错误;还原性:S2->F-,D错误。
B为Mg、C为F,A为S。F无正价,A错误;离子半径:S2->F->Mg2+,B正确;气态氢化物的稳定性:H2S<HF,C错误;还原性:S2->F-,D错误。
4.科技文献中经常出现下列词汇,其中与相关物质的颜色并无联系的是( )
A.赤色海潮 B.白色污染
C.绿色食品 D.棕色烟气
[解析]选C。海水中N、P含量较高时,会引起藻类植物疯长,使海水呈红色,称为赤色海潮;塑料制品废弃物在自然界中较难降解,对环境造成污染,因塑料大多数为白色,故称为白色污染;工业废气中含Fe2O3 较高时,会使废气呈现棕色,对环境造成危害,而绿色
较高时,会使废气呈现棕色,对环境造成危害,而绿色 食品是指无污染的食品,并非指绿颜色的食品,故选C。
食品是指无污染的食品,并非指绿颜色的食品,故选C。
3.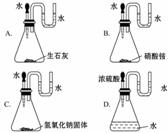 如图,加入水或酸后,各装置U形管中的液柱左边高于右边的是( )
如图,加入水或酸后,各装置U形管中的液柱左边高于右边的是( )
[解析]选B。生石灰、氢氧化钠固体、浓H2SO4溶于水时会放出大量的热,使锥形瓶内气体压强增大,导致U形管中的液柱左边低,右边高;硝酸铵固体溶于水时吸收热量,导致锥形瓶内气体压强减小,使U形管中液柱左边高,右边低,故选B。
2.下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铝片与稀盐酸反应
B.Ba(OH)2·8H2O与NH4+Cl的反应
C.灼热的碳与CO2的反应
D.甲烷在氧气中的燃烧反应
[解析]选C。金属与酸的反应是放热反应;燃烧是放热反应;Ba(OH)2·8H2 O和NH4+Cl的反应是吸热反应但不是氧化还原反应;碳和CO2的反应既是氧化还原反应又是吸热反应。
O和NH4+Cl的反应是吸热反应但不是氧化还原反应;碳和CO2的反应既是氧化还原反应又是吸热反应。
1.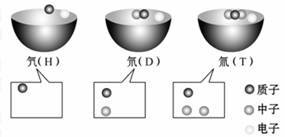 科学家们发现有3种氢原子,氕、氘、氚这3种氢原子中质子、中子
科学家们发现有3种氢原子,氕、氘、氚这3种氢原子中质子、中子 和电子的数量关系如图所示:
和电子的数量关系如图所示:
则下列说法不正确的是( )
A.H、D、T原子中质子数相同,核外电子数也相同
B.H、D、T原子属于三种不同核素
C.H、D、T原子互为同位素
D.元素的原子都是由质子、中子、电子构成的
[解析]选D。H、D、T是氢元素的三种不同核素,互称为同位素,同位素原子中质子数相同,核外电子数相同,不同的是中子数,且氕原子无中子,故只有D不正确。
21.(14分)(2009·泰安模拟)有A、B两位学生均想利用原电池反应验证金属的活动性顺序, 并探究产物的有关性质, 分别设计了如图所示的原电池, 请回答:
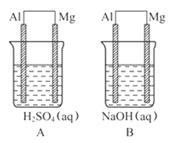
(1)指出各原电池中的负极材料并写出其电极反应式。
①负极材料:
A池_________, B池_______。
②电极反应式:
A池: 正极:__________________________________ ,
负极:______________________________________ 。
B池: 正极:__________________________________ ,
负极 :
______________________________________。
:
______________________________________。
(2)B池总反应的离子方程式为_________________。
(3)上述实验证明了“利用金属活动性顺序表直接判断原电池正、负极”, 这种作法_______(填“可靠”或“不可靠”), 如不可靠请你提出另一种判断原电池正、负极的可行方案___________ 。 (若你认为可靠, 此空可不做答)
(4)从构成原电池的几个组成部分来看, 判断原电池负极, 除了要考虑金属的活泼性外, 还要考虑_________
___________________________________________。

答案: (1)①Mg Al
②2H+ +2e- ==== H2↑
Mg-2e- ==== Mg2+
2H2O+2e- ==== 2OH- +H2↑
Al+4OH--3e-
==== 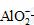 +2H2O
+2H2O
(2)2Al+2OH-
+2H2O
==== 2 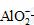 +3H2↑
+3H2↑
(3)不可靠 将两种金属电极连上电流计而构成原电池, 利用电流计检测电流的方向, 从而判断电子流动方向, 由此确定原电池正、负极
(4)①电解质溶液的性质; ②较易与电解质溶液反应的金属作原电池的负极
20.(15分)下表为元素周期表的一部分, 请参照元素①-⑧在表中的位置, 用化学用语回答下列问题:
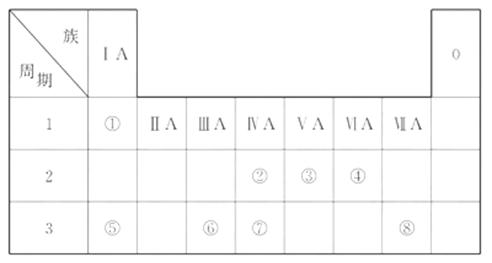
(1)④、⑤、⑥的原子半径由大到小的顺序为_______(填元素符号)。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_______________(填化学式)。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物, 写出其中一种化合物的电子式: ______________________________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解, 可使用的催化剂为(填序号)_________________。
a. MnO2 b. FeCl3 c. Na2SO3 d. KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为_________________,
N→⑥的单质的化学方程式为___________________。
[解析]本题以元素周期表为题材,
考查原子半径比较, 酸性强弱、电子式、离子方程式以及盐类水解等知识。(1)⑤⑥位于同一周期, 且⑤排在⑥的前面, 原子半径大, 而④在上一周期, 比⑤、⑥少一个电子层, 故半径最小。(2)②⑦位于同一主族, 上面的非金属性强, 最高价含氧酸酸性强, ②③位于同一周期, 且③在后, 非金属性强, 对应的酸性强。(3)四种元素分别为氢、氧、钠和氯, 离子键显然必须是钠盐, 极性共价键则应有两种非金属元素组成。
且⑤排在⑥的前面, 原子半径大, 而④在上一周期, 比⑤、⑥少一个电子层, 故半径最小。(2)②⑦位于同一主族, 上面的非金属性强, 最高价含氧酸酸性强, ②③位于同一周期, 且③在后, 非金属性强, 对应的酸性强。(3)四种元素分别为氢、氧、钠和氯, 离子键显然必须是钠盐, 极性共价键则应有两种非金属元素组成。
(4)液态H2O2可以在MnO2、FeCl3等催化剂作用下发生分解反应。(5)⑥为Al, 可推断Z为Al(OH)3, 受热分解可产生Al2O3, 再电解即可得单质铝。M仅含非金属的盐, 显然为铵盐, 所以X与Y应为AlCl3与NH3·H2O的反应, 生成NH4+Cl。由于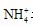 水解, 故要使其浓度与Cl-
相等, 则要补充NH3·H2O。
水解, 故要使其浓度与Cl-
相等, 则要补充NH3·H2O。
答案: (1)Na>Al>O
(2)HNO3>H2CO3>H2SiO3
(3) 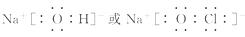
(4)a、b
(5)Al3+ +3NH3·H2O==== Al(OH)3↓+3
2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
19. (4分)已知拆开1 mol H-H键、1 mol I-I键、
1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、
299 kJ。则由氢气和碘反应生成1 mol HI需要______(填“放出”或“吸收”)______ kJ的热量。氢气、碘和碘化氢三种分子最稳定的是_________。
[解析]根据 反应H2+I2 ==== 2HI, 形成2 mol HI放出2×299 kJ的热量, 所以生成1 mol HI时放出热量为
反应H2+I2 ==== 2HI, 形成2 mol HI放出2×299 kJ的热量, 所以生成1 mol HI时放出热量为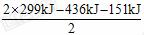 =5.5
kJ。
=5.5
kJ。
键能越大, 分子越稳定, 故H2分子最稳定。
答案: 放出 5.5 H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com