
题目列表(包括答案和解析)
11.(2009·广东高考)元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+ 与Z2- 具有相同的核外电子层结构。下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
[解析]选B。由X+ 与Z2- 具有相同核外电子层结构分析:X若为K,则Z为S,根据X、Y、Z原子序数之和为36推测Y只能为H,显然与“X、Y在同一周期”不符。所以X只能为Na、Z为O、Y为Cl,结合元素周期律可知B项不正确。
10.(2010·济宁高一检测)下面是用电子式表示某些物质的形成过程 ,其中正确的是( )
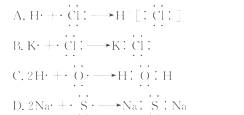
[解析]选C。HCl不是离子化合物,A错;KCl、Na2S是离子化合物,电子式书写错误,B、D错误,只有C正确。
9.下列每组物质中含有化学键类型相同的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2
D.Na2O2、H2O2、H2O、O3
[解析]选C。解此类题目的关键在于弄清各类化学键的形成本质。离子键是由阴、阳离子相互作用形成的,非极性键是由同种元素原子形成的共价键,极性键是由不同种元素原子形成的共价键。A组中NaCl与NaOH中含有离子键,而HCl和H2O中只有共价键,NaOH中既含有离子键又含有共价键;B组中Cl2、HCl、SO2中只含共价键,而Na2S中只含离子键;而C组中均只含有共价键;D组中Na2O2含离子键、共价键,H2O2、H2O、O3中只含共价键,故C正确。
8.(多选)M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成离子化合物Z。下列说法中正确的是( )
A.Z可表示为MY2
B.Z可表示为M2Y
C.Z的电子式可表示为 
D.M形成+2价阳离子
[解析]选A、D。M的一个原子失去2个电子,转移到2个Y原子中,故离子化合物Z可表示为MY2,其中存在M2+,A、D正确;Z的电子式不应把2个Y- 合并。
7.A、B、C、D、E五种元素同周期从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如下:

下列说法中正确的是( )
A.E元素的最高化合价为+7时,D元素的负化合价可为-2价
B.A(OH)n为强碱时,B(OH)m也一定为强碱
C.HnDOm为强酸时,E的非金属性一定很强
D.HnCOm为强酸时,E的单质可能有强还原性
[解析]选A。A项,若E元素的最高化合价为+7时,D元素的最高化合价必为+6价,则D元素的负化合价可为-2价。
A(OH)n为强碱时,B(OH)m可能为强碱,也可能为中强碱,还可能为弱碱。HnDOm为强酸,即D元素原子得电子能力很强,原子序数比D大1的E可能为原子得电子能力比D强的非金属元素,也可能为稀有气体元素。元素C与元素E的关系可有这样例子:C是16S,E是18Ar。
6.下列递变情况中不正确的是( )
A.钠、镁、铝原子的最外层电子数依次增多
B.硅、磷、硫、氯元素的最高正化合价依次升高
C.碳、氮、氧、氟的原子半径依次增大
D.锂、钠、钾、铷的金属性依次增强
[解析]选C。同一周期从左至右,原子半径依次减小。
5.下列操作能达到实验目的的是( )
A.检验钠和钾:分别取小粒投入含酚酞的水中,观察溶液颜色变化
B.检验氯化钠、溴化钾、碘化钾溶液:分别滴加溴水,再加入四氯化碳,振荡,观察颜色
C.除去氯化钠中的少量碘单质:加热
D.证明钾比钠活泼:向氯化钠水溶液中加入一小粒钾,观察现象
[解析]选C。钠和钾都能溶于水生成强碱;溴不能与溴化钾和氯化钠反应;碘易升华,加热可除去氯化钠中的少量碘单质;钾与盐的水溶液反应时,先与水发生置换反应。
4.(2010·成都高一检测)两种粒子的核外电子排布相同,核电荷数不同,则它们可能是( )
A.两种不同元素的原子
B.一定是两种不同的离子
C.同一元素的原子和离子
D.两种不同元素的原子和离子
[解析]选D。由于两种粒子的核外电子排布相同,即电子数相同,可能是原子,也可能是离子,核电荷数不同,不属于同种元素。
3.关于卤族元素的下列叙述中正确的是( )
A.卤族元素是典型的非金属元素,因此不能与其他非金属元素反应
B.卤族元素单质越活泼,其熔点和沸点就越高
C.卤族元素单质都能与水剧烈反应
D.卤族元素单质都能和氢气反应,且生成的气态氢化物的稳定性随单质氧化性的增强而增强
[解析]选D。卤族元素位于周期表中第ⅦA族,均为非金属元素,能与H2化合生成卤化氢,均能与水反应,只有F2反应相当剧烈,卤素单质的活泼性与其物理性质没有直接关系,故选 D。
2.下列离子中,电子数大于质子数,且质子数大于中子数的是( )
A.D3O+ B.Li+ C.OD- D.OH-
[解析]选D。D3O+ 的质子数为11,电子数为10,中子数为11;Li+ 的质子数为3,电子数为2,中子数为4;OD- 的质子数为9,电子数为10,中子数为9;OH- 的质子数为9,电子数为10,中子数为8,故选D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com