
题目列表(包括答案和解析)
3.等质量的乙烯和聚乙烯完全燃烧消耗氧气的物质的量的关系是( )
A.前者大 B.后者大
C.相等 D.不能确定
[解析]选C。加聚产物是单体中的不饱和键断裂相互连接在一起而形成的,所以加聚产物的元素组成及质量分数与单体完全相同。
2.下列措施不能达到节能减排目的的是( )
A.利用太阳能制氢燃料
B.用家用汽车代替公交车
C.利用潮汐发电
D.用节能灯代替白炽灯
[解析]选B。用家用汽车代替公交车只能降低交通工具的使用效率,增大化石燃料的用量,从而增大能量的消耗,不能达到节能减排的目的,故选B项。
1.我国古代曾用火烧孔雀石的方法炼铜。孔雀石的主要成分是Cu2(OH)2CO3,其冶炼方法是( )
A.焦炭还原法 B.湿法炼铜
C.铝热还原法 D.电解冶炼法

16.(12分)(2009·福建高考改造题) 短周期元素Q、R、T、W在元素周期表中 的位置如图所示,其中T所处的周期序 数与主族序数相等,
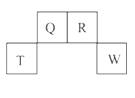
请回答下列问题:
(1)T的原子结构示意图为_____ 。
(2)元素的非金属性为(原子的得电子能力):Q _____ W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____ 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是_____。
(5)R有多种氧化物,其中氧化物甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是_____ 。
[解析]结合题目信息及T所处的周期序数与主族序数相等这一条件,可以得出T为Al,Q为C,R为N,W为S。(1)T为Al,13号元素。(2)根据S、C最高价氧化物对应的酸性硫酸强于碳酸,则可得非金属性S强于C。(3)S与H2SO4发生归中反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价看,只能是SO2。(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应。(5)N中相对分子质量最小的氧化物为NO,2NO+O2====2NO2,显然NO过量1 L,同时生成1 L的NO2,再用NaOH溶液吸收,从氧化还原角度看,+2价N的NO与+4价N的NO2,应归中生成+3价N的化合物NaNO2。

0.1 mol H2,说明此元素显+1价,即为钠元素;D的原子核中没有中子,说明为氢元素。

15.(14分)(2010·东营高一检测)现有A、B、C、D 4种元素,前3种元素的离子都和氖原子具有相同的核外电子排布。A元素没有正化合价;B的氢化物分子式为H2B,0.2 mol的C单质能从酸中置换出2.24 L H2(标准状况)。D的原子核中没有中子。
(1)根据以上条件,推断A、B、C、D的元素名称:
A. _________ , B. _________ ,
C. _________ , D. _________ 。
(2)用电子式表示C与A、C与B、B与D相互结合成的化合物,指出其化合物的类型及化学键类型:
C+A:电子式_______ ,化合物类型:_______ ,化学键类型:________ 。
C+B:电子式________ ,化合物类型:________ ,化学键类型:________ 。
B+D:电子式________ ,化合物类型:________ ,化学键类型:________ 。
(3)写出C与B所形成的化合物与D与B所形成的化合物反应的离子方程式:________ 。
[解析]题给信息中A、B、C的离子结构与氖原子的结构相同,说明A、B、C是第二周期的非金属元素或第三周期的金属元素;B的气态氢化物的分子式为H2B,说明B一定是氧元素;A是没有正价态的化合物,说明A很活泼且只能得电子,为活泼的非金属元素氟;C与酸反应能产生H2,说明C为金属元素且在第三周期,再由0.2 mol C 可产生
14.(14分)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大。已知Y与Z的原子次外层的电子数均为2,W、X的原子次外层的电子数均为8。
(1)写出各元素的名称:
X _____ ,Y _____ ,Z _____ ,W _____ 。
(2)写出它们在元素周期表中的位置:
X _____ ,Y _____ ,Z _____ ,W _____ 。
(3)写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式: _____ 。
(4)按碱性减弱、酸性增强的顺序写出各元素最高价氧化物对应水化物的分子式: _____, _____, _____, _____ 。
[解析]从题目给的信息知,Y、Z为第二周期元素,W、X为第三周期元素,再由最高正价知:X为钠,Y为碳,Z为氮,W为氯。
答案:(1)钠 碳 氮 氯
(2)第三周期ⅠA族 第二周期ⅣA族 第二周期ⅤA族 第三周期ⅦA族
(3)Na2O+2HNO3====2NaNO3+H2O
(4)NaOH H2CO3 HNO3 HClO4
13.(12分)写出下列各粒子的化学式:
(1)由2个原子组成的具有10个电子的分子是_____ ,
阴离子是_____ 。
(2)由4个原子组成的具有10个电子的分子是_____ ,
阳离子是_____ 。
(3)由3个原子组成的具有10个电子的分子是_____ 。
(4)由5个原子组成的具有10个电子的阳离子是_____ 。
[解析]在常见的有10个电子的分子中主要是非金属元素的气态氢化物分子,阴阳离子也是由非金属元素与氢形成的原子团,此类非金属元素原子核外电子数均小于10。
答案:(1)HF OH- (2)NH3 H3O+
(3)H2O (4)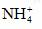
13.(8分)根据周期律对角线规则,金属Be与铝单质及其化合物的性质相似。又知AlCl3熔、沸点较低,易升华,熔融状态不导电,试回答:
(1)比较Be2+ 、Li+ 、H+ 微粒半径的大小: _____ 。
(2)写出BeO与NaOH溶液反应的离子方程式(生成Na2BeO2): _____ 。
(3)Be(OH)2、Mg(OH)2可用试剂_____鉴别,其离子方程式为_____ 。
(4)BeCl2是_____(填“离子化合物”或“共价化合物”)。

12.有三种短周期元素X、Y、Z,已知其最高价氧化物对应的水化物的酸性强弱是H2XO3<H3YO4<HZO3,则X、Y、Z的非金属性强弱顺序是( )
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Z>Y>X
[解析]选D。本题主要考查元素的最高价氧化物对应水化物酸性的强弱与非金属性强弱的递变规律。由于非金属性越强,对应的最高价氧化物的水化物的酸性越强,因此,三种元素的非金属性强弱顺序是Z>Y>X。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com