
题目列表(包括答案和解析)
3.下列各组的三种元素,属于同一周期的是( )
A.C、H、O B.Li、Na、K
C.Si、P、S D.F、Cl、Br
[解析]选C。A选项中,C和O属于第2周期元素,而H属于第1周期元素;B选项中,Li、Na、K都属于ⅠA族元素,分属2、3、4三个不同的周期;C选项中,Si、P、S都属于第3周期元素;D选项中,F、Cl、Br都属于ⅦA族元素,分属2、3、4三个不同的周期。
1.(2010·泰安高一检测)下列叙述错误的是( )
A.原子间通过共用电子对形成的化学键叫共价键
B.阴、阳离子之间通过静电作用形成的化学键叫做离子键
C.化学键是相邻的原子之间强的相互作用
D.化学键是既存在于相邻原子间,也存在于相邻分子间的相互作用
[解析]选D。化学键是相邻的原子之间强的相互作用,只存在于相邻的原子之间,相邻的分子之间存在的相互作用叫分子间作用力,不属于化学键,其强度比化学键要弱得多。

[解析]选D。选项A是表示碳的两种同位素,选项B指氧元素的两种同素异形体;选项C中两结构简式表示的是同一种物质,因为该分子的结构是以中心碳原子为中心的四面体。
16.(18分)某校化学课外兴趣小组的学生为了验证乙醇的分子结构,设计了如下实验程序:乙醇的组 成元素的测定、分子式的测定、分子结构的测定。
成元素的测定、分子式的测定、分子结构的测定。
(1)该组同学用燃烧乙醇分析产物来确定乙醇中含有C、H两种元素。简要说明其具体操作:①证明含有氢元素的操作是_________________________________。
②证明含有碳元素的操作是______________________。
(2)要用燃烧分析产物法证实乙醇中还含有氧元素时,需取得一些实验数据,这些数据应该是____________。
(3)为确定乙醇的分子式,除(2)中数据外,还需不需 要测定乙醇的相对分子质量?并说明理由。 ________。
要测定乙醇的相对分子质量?并说明理由。 ________。
(4)为测定乙醇的分子结构,该小组同学用了无水乙醇和金属钠反应收集生成氢气的方法,选用了如图所示的仪器(有的仪器配用双孔橡皮塞)。
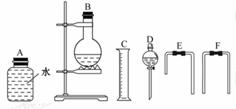
①装置的连接顺序是___接___接___接___接___接___。
②由实验证明乙 醇
醇 的分子结构是CH3CH2OH而不是CH3OCH3的理由是
的分子结构是CH3CH2OH而不是CH3OCH3的理由是 _____ 。
_____ 。
[解析](1)利用燃烧规律来确定乙醇分子中含有C、H两种元素,可以取用一干燥小烧杯罩在酒精灯火焰上,发现烧杯内壁有水珠生成,证明产物有水,从而证明乙醇分子中含有氢元素;然后迅速将烧杯倒转,向烧杯中加入少量澄清石灰水,发现石灰水变浑浊,证明有CO2生成,从而说明乙醇分子中含有碳元素。
(2)要测定乙醇分子中还含有氧元素,应知道乙醇的质量[m(乙醇)]及生成物CO2和H2O的质量,依据质量守恒即可求出氧原子质量m(O)=m(乙醇)-m(C)-m(H)>0,确定含有氧元素。
(3)不需要,因为据(2)可以求出乙醇分子中C、H、O三种原子的原子个数比为2∶6∶ 1,最简式为C2H6O,而此时碳原子已达饱和,故C2H6O即为乙醇的分子式。
1,最简式为C2H6O,而此时碳原子已达饱和,故C2H6O即为乙醇的分子式。
(4)①乙醇与Na的反应为固体与液体不需加热型,而生成的H2利用排水法测定其体积,故装置为D→B→E→A→F→C。
②1 mol的乙醇分子生成标准状况下0.5 mol H2,证明乙醇分子中有1个氢原子与其他氢原子不同,从而说明乙醇结构为CH 3CH2OH。
3CH2OH。
答案:(1)①取一干燥小烧杯罩在酒精灯火焰上②待小烧杯内壁有水珠生成后,迅速倒转烧杯,向其中加入少量澄清石灰水
(2)乙醇的质量,CO2的质量,水的质量
(3)不需要,因为据(2)中的数据可以计算出乙醇分子中C、H、O原子个数比为2∶6∶1,即最简式为C2H6O,而碳原子数已达饱和,故C2H6O就是其分子式
(4)①D B E A F C
②根据1 mol乙醇与Na完全反应生成0.5 mol H2,证明1个乙醇分子中有1个氢原子被Na置换,所以乙醇的结构为CH3CH2OH
15.(12分)近年来,乳酸成为人们的研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过发酵制备。利用乳酸聚合而成的高分子材料具有生物相容性,而且在哺乳动物体内或自然环境中,都最终降解成为二氧化碳和水。乳酸还有许多其他用途。请回答下列问题。
(1)乳酸可发生下列变化:
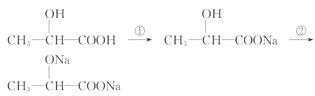
各步反应所用的试剂分别是:① _____ ,② _____ 。
(2)乳酸可以与精制铁粉制备一种药物,反应化学方程式是________________________________ 。
该反应中氧化剂是: _____ ,还原产物是_____ 。
(3)若碳原子以单键与4个不同的原子或原子团相结合,
则该碳原子被称为“手性碳原子”,含手性碳原子的分子
称为“手性分子”,手性分子往往具有一定的生物活性。
乳酸分子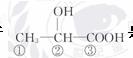 是手性分子,其中的手性
是手性分子,其中的手性
碳原子是_____号碳原子。
[解析](1)反应①只消耗羧酸,不消耗羟基,故可用NaOH或Na2CO3或NaHCO3,反应②能与羟基反应,故用Na。
(2)较活泼金属铁只能与羧基反应,不与羟基反应。
(3)据信息可看出②号碳为手性碳。
答案:(1)①NaOH溶液或Na2CO3溶液或NaHCO3溶液等 ②Na

14.(12分)下图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。
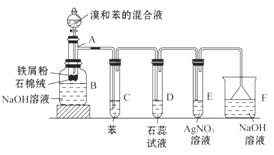
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式): _____ 。
(2)试管C中苯的作用是_____ 。反应开始后,观察D和E两试管,看到的现象为_____ 。
(3)反应2 min-3 min后,在B中的NaOH溶液里可观察到的现象是______________________________。
(4)在上述整套装置中,具有防倒吸作用的仪器有_____ (填字母)。
(5)该实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这三个优点外,还有一个优点是_____ 。
[解析](1)苯与液溴在加入铁粉后发生反应:
2Fe+3Br2====2FeBr3, 
(2)利用苯除去Br2(g),可防止Br2(g)进入D或E,干扰HBr的检验,生成HBr会使D中石蕊试液变红且导管口有白雾产生,在E中HBr与AgNO3反应会生成AgBr淡黄色沉淀。
(3)NaOH溶液可除去溴苯中的溴,从而在溶液底部生成无色油状液体。
(4)D、E试管中导管未插入液面以下,可防倒吸。
(5)考虑装置优缺点时,首先想到能否防污染。
答案:(1) 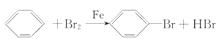
(2)除去HBr气体中混有的溴蒸气
D管中石蕊试液慢慢变红,并在导管口有白雾产生,而后E管中出现浅黄色沉淀
(3)在溶液底部有无色油状液体
(4)D、E、F
(5)充分吸收有毒气体,防止污染大气
13.(10分)如图为人体在某项生理过程中发生的化学反应示意图。

(1)图中标有字母的物质中,_____代表酶,其化学本质是_____ ,基本组成单位是_____ 。
(2)如果B代表蔗糖,则C和D各代表_____ 。
(3)下列关于葡萄糖与蔗糖相比较的说法中错误的是_____ 。
A.它们的分子式不同,但化学元素组成相同
B.蔗糖能 水解,葡萄糖却不能
水解,葡萄糖却不能
C.它们是同分异构 体
体
D.葡萄糖是单糖,蔗糖是双糖
[解析](1)可以看出A在反应前后分子结构并未发生改变,而在反应过程中起了促进B转化成C和D的作用,故A代表酶,酶的化学本质是蛋白质,基本组成单位是氨基酸。(2)蔗糖属于双糖,它是由1分子葡萄糖和1分子果糖结合形成的,故 C和D代表葡萄糖和果糖。(3)根据所学的生物、化学知识,可判断错误的是C。
C和D代表葡萄糖和果糖。(3)根据所学的生物、化学知识,可判断错误的是C。
答案:(1)A 蛋白质 氨基酸 (2)葡萄糖和果糖 (3)C
12.某有机物的结构简式为CH2==CH-COOH,该有机物不可能发生的化学反应是( )
A.水解反应 B.酯化反应
C.加成反应 D.氧化反应
[解析]选A。该有机物含有碳 碳双键,能发生加成反应、氧化反应,含有羧基能发生酯
碳双键,能发生加成反应、氧化反应,含有羧基能发生酯 化反应,故选A。
化反应,故选A。
11.(2010·杭州高二检测)A、B两种有机化合物,当混合物质量一定时,无论A、B以何种比例混合,完全燃烧时产生的CO2的量均相等,符合上述条件的是( )
①同分异构体; ②同系物; ③具有相同的最简式; ④含碳的质量分数相同
A.①③④ B.①③
C.①②③④ D.①②④
[解析]选A。当混合物质量一定时,无论A、B以何种比例混合,完全燃烧时产生的CO2的量均相等,说明两种有机化合物中碳元素的质量分数相等。当两种有机化合物互为同分异构体或具有相同的最简式时满足上述条件。
9.下列说法中,错误的是( )
A.无论乙烯的加成,还是乙烯使酸性KMnO4溶液褪色,都与乙烯分子内含有碳碳双键有关
B.无论使用溴的四氯化碳溶液还是酸性KMnO4溶液都可以鉴别乙烯和乙烷
C.相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同
D.乙烯的化学性质比乙烷的化学性质活泼
[解析]选C。乙烯分子中含有碳碳双键,因此,易与Br2发生加成反应,能还原酸性KMnO4溶液而使之褪色,而乙烷不与Br2及KMnO4发生反应,因此可以用来鉴别二者,同时也说明了乙烯化学性质更活泼。因为乙烯与甲烷分子均含有4个氢原子,但二者相对分子质量不同,因此等质量时完全燃烧生成的水质量不同。

A.属于芳香烃
B.易溶于水
C.1 mol A可以与2 mol NaOH反应
D.一定条件下可发生加成反应和氧化反应
[解析]选D。从分子结构可知A属于烃的衍生物,不属于芳香烃,A分子无羟基、羧基等,属于酯类,应难溶于水,A水解生成苯甲酸钠和乙醇,1 mol A可以与1 mol NaOH反应,故A、B、C均不对,A含有苯环和碳氧双键,在一定条件下可发生加成反应和氧化反应。
8.某学生用化学知识解决生活中的问题,下列家庭小实验不合理的是(  )
)
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验食盐中是否含碘酸钾(KIO3)
C.用纯碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
[解析]选B。利用
2CH3COOH+CaCO3====(CH3COO)2Ca+H2O+CO2↑这一反应,可以用食醋来除去暖水瓶中的水垢,A正确;淀粉遇I2变蓝而遇KIO3不变色,故无法检验NaCl中的KIO3,B不正确;因纯碱溶液显碱性,可以促进油脂的水解,C正确;纯羊毛为蛋白质,灼烧时有烧焦羽毛的气味,而棉织物为纤维素,不具有该性质,D正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com