
题目列表(包括答案和解析)
16.(12分)在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的化学式是________;X与氢元素形成的化合物的电子式是________ 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是_______;D与E能形成一种结构与CO2相似的分子,该分子的结构式为_____;D所在族元素的氢化物中,沸点最低的是_____。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是_______。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为___________________________。
[解析]X、Y组成的化学式为XY2,且为离子化合物,所以X为+2价,Y为-1价,设Y的电子数为a,则X的电子数为(a+3),所以2a+a+3=54,a=17,Y为Cl,X为Ca。D与Cl相邻,D的最外层电子数是电子层数的2倍,所以D为S,E为C。W与Cl同周期,其单质是原子晶体,所以W为Si元素,Z的单质Z2有3个共价键,Si与Z能形成一种新型无机非金属材料,所以Z为N。
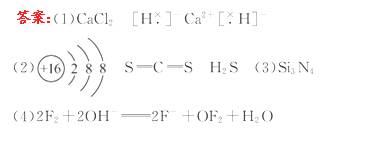
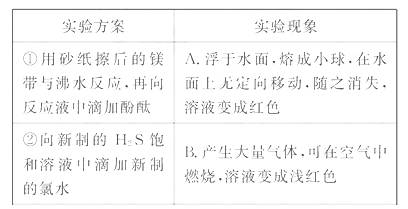
15.(18分)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如表。
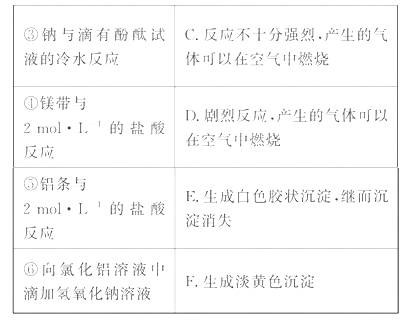
请你帮助该同学整理并完成实验报告。
(1)实验目的:______________________。
(2)实验用品:
仪器:试管、酒精灯、砂纸、镊子、小刀、胶头滴管等;
药品:镁条、钠、铝条、新制氯水、新制饱和硫化氢溶液、2 mol·L-1的盐酸、2 mol·L-1的NaOH溶液、蒸馏水、酚酞试液、2 mol·L-1的AlCl3溶液。
(3)实验内容(填写题给信息表中的序号):
(4)实验结论:______________________。
(5)请你补充一组实验方案(简单易行),证明此周期中另外两种元素的性质递变规律: ______________。
[解析](1)先分析每个实验可得出的结论:通过实验①可得出镁跟水反应的难易、氢氧化镁的碱性强弱;通过实验②可得出Cl2能从H2S中置换出S;实验③可得出钠跟水反应的难易、氢氧化钠的碱性强弱;实验④、⑤分别可得出镁、铝跟盐酸置换反应的难易;实验⑥可得出氢氧化铝是一种两性氢氧化物。把上述分析结果联成一个整体来看,可发现这6个实验都是研究第3周期元素的单质和化合物的性质,从中可定性地比较出钠、镁、铝三种元素的金属性强弱,氯、硫两种元素的非金属性强弱。所以,这一套实验的目的是“验证第3周期元素从左至右金属性逐渐减弱、非金属性逐渐增强的规律”。 (3)根据元素周期
表第3周期元素的排列顺序,作了有序地研究,可确定实验操作顺序和相关的实验现象等(如下表)。
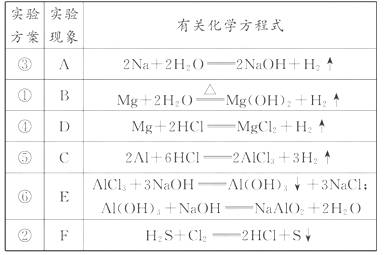
(4)金属性:Na>Mg>Al;非金属性:S<Cl。
(5)第3周期还有磷、硅两种元素,要完整的比较出这些元素的金属性和非金属性,必须要补充实验。联系到元素最高价含氧酸的酸性与元素非金属性的关系,可以比较硅酸、磷酸的酸性强弱来比较Si、P元素的非金属性强弱。在中学化学知识范围内可设计出下列三种方案:
方案一:测定0.1 mol·L-1的Na2SiO3、Na3PO4的pH,由此判断两种盐溶液的水解能力,得出硅酸、磷酸两种最高价含氧酸的酸性强弱顺序,进而得出硅、磷两元素非金属性强弱顺序。
14.(10分)已知X、Y、Z、W四种元素位于周期表中三个不同周期,且均为短周期元素,原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y元素的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号:
X、______Y、 ______ Z、 ______ W ______ 。
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式为____________________。
(3)由X、Y、Z所形成的离子化合物是_______,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式是____________________________________。


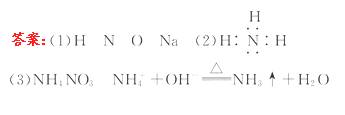
13.(12分)下表是元素周期表的一部分,针对表中的①-⑧中元素,填空回答。
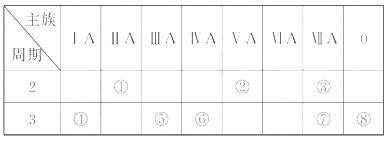
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为___________。
(2)③⑤⑦元素原子形成简单离子的离子半径由大到小的顺序是___________(填离子符号)。
(3)某元素二价阳离子的核外有10个电子,该元素是__________(填元素名称)。
(4)在这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱溶液反应的是___________(填化学式)。
(5)这些元素形成的单质中,可用于制造晶体管、集成电路等电子元件的是________(填元素符号);它的氧化物可与焦炭反应生成它的单质的化学方程式为______。
(6)④的单质与水反应的化学方程式是________(并标出电子转移的方向与数目)。
(7)⑦元素的单质常温下的颜色是________,并用电子式表示⑦元素的氢化物形成过程为_____________。
(8)已知某些不同族元素的性质也有一定的相似性,如元素①与⑤元素的氢氧化物有相似的性质,写出元素①的氢氧化物与NaOH溶液反应的化学方程式____________
___________________________。
[解析]首先判断每个数字所代表的元素,将元素符号填入下表,然后再根据题目要求做答。
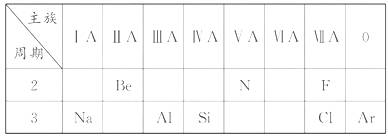
(1)化学性质最不活泼的原子是Ar。
(2)Cl- 和F- 是同一主族元素形成的离子,原子序数越大,半径越大;Al3+ 和F- 具有相同的电子层排布,原子序数越大,半径越小。所以离子半径由大到小的顺序是Cl->F->Al3+。
(3)二价阳离子的核外有10个电子,说明失去2个电子后剩余10个电子,所以该原子有12个电子,该元素是镁元素。


11.下列各组给定原子序数的元素,不能形成原子数之比为1∶1稳定化合物的是( )
A.3和17 B.1和8 C.1和6 D.7和12
[解析]选D。本题考查原子序数、原子结构与物质构成的关系。应先根据已知的原子序数确定对应的元素,然后将具体元素代入后再判断。各选项对应的元素和构成符合要求的化合物依次是:
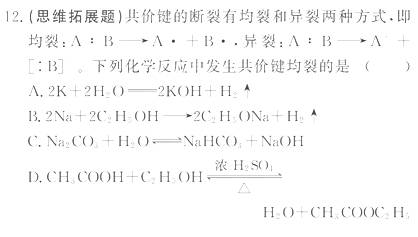
[解析]选D。从题中所给信息可以判断,均裂时共价键断裂产生了单电子,最终形成共价键,异裂时共价键断裂产生了阴阳离子,最终形成离子键,所以A、B、C项的反应为异裂,只有D项的反应为均裂。
8.(2010·海安高一检测)根据元素周期表和元素周期律,判断下列有关描述正确的是( )
A.碱金属元素中,金属活泼性最强的是Li
B.第3周期元素中,原子半径最大的是Cl
C.短周期元素最高价氧化物对应的水化物中,酸性最强的是H2SO4
D.所有元素的气态氢化物中,最稳定的是HF
[解析]选D。碱金属元素随着原子序数的递增,金属性逐渐增强,所以Fr是元素周期表中最活泼的金属;同一周期的元素中,随着原子序数的递增,原子半径逐渐减小,所以在第3周期元素中,原子半径最大的是Na;在最高价氧化物对应的水化物中,HClO4的酸性最强;氟元素的非金属性最强,其气态氢化物HF最稳定。

[解析]选D。因为电子式中的小黑点表示的是原子的最外层电子数,所以该元素最外层有5个电子,为VA族元素,最高价为+5价,最低价为-3价,所以气态氢化物分子式为RH3。

7.X、Y、Z是原子序数依次递增的三种短周期元素。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物。则下列说法一定正确的是( )
A.其中有硫元素
B.其中有金属元素
C.这三种元素能够组成盐
D.这三种元素均位于不同周期
[解析]选C。根据X原子的电子层数与它的核外电子总数相同可推断X为氢元素,根据Z原子的最外层电子数是次外层电子数的三倍可推断Z为氧元素,根据X、Y、Z原子序数依次递增、Y和Z可以形成两种以上气态化合物,可推断Y、Z同在第2周期,D选项错误;Y应为氮元素,三种元素能够组成硝酸铵(铵盐是惟一的全部由非金属元素组成的盐),C选项正确。
6.下列叙述中正确的是( )
A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素
[解析]选C。本题考查元素周期表的结构。熟练掌握元素周期表的结构是解答本题的关键。

5.关于元素周期律和周期表的下列说法正确的是( )
A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B.元素的性质随着原子序数的增加而呈周期性变化
C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献
D.同一主族的元素从上到下,金属性呈周期性变化
[解析]选B。在元素周期表中,同一主族的元素从上到下由于原子半径增大,金属性逐渐增强,非金属性逐渐减弱,属于递变性变化而不是周期性变化。
4.下列式子中,真实表示物质分子组成的是( )
A.H2O B.金刚石(C)
C.SiO2 D.NH4+Cl
[解析]选A。只有分子晶体才由分子组成,题中所涉及的物质中,H2O为分子晶体,金刚石和SiO2为原子晶体,NH4+Cl是离子晶体。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com