
题目列表(包括答案和解析)
16.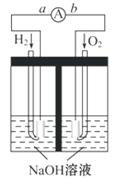 (14分)(2009·天津高考,改造题)
(14分)(2009·天津高考,改造题)
氢氧燃料电池是符合绿色化学理念的新型
发电装置。如图为电池示意图,该电池电
极表面镀一层细小的铂粉,吸附气体的
能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化形式主要
是______,在导线中电子流动方向为
______(用a、b表示)。
(2)负极反应式为__________________。
 (3)电极表面镀铂粉的原因为_________。
(3)电极表面镀铂粉的原因为_________。

[解析]本题考查电化学知识。(1)原电池的实质为化学能转化成电能。总反应为2H2+O2====2H2O,其中H2中的氢元素从零价升至+1价,失去电子,即电子从a流向b。(2)负极为失去电子的一极,即H2失去电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-。(3)铂粉的接触面积大,可以加快反应速率。(4)Ⅰ.Li 从零价升至+1价,作还原剂。Ⅱ.H2O中的H从+1价降至H2中的零价,作氧化剂。
答案:(1)由化学能转化为电能 由a到b
(2)2H2+4OH--4e- ====4H2O或
H2+2OH--2e- ====2H2O
(3)增大电极单位面积吸附H2 、O2分子数,加快电极反应速率 (4)Li H2O
、O2分子数,加快电极反应速率 (4)Li H2O
问题:
(1)试分析实验一中t1-t2速率变化的主要原因是_____,
t2-t3速率变化的主要原因是__________。
(2)实验二放出氢气量减少的原因是 ________。
________。
(3)某同学认为实验三和四反应速率加快原因,均因为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。
[解析](1)从图中可知速率曲线从t1时某一高度上升到t2后下降,这与盐酸的浓度随反应进行,t1→t2→t3逐渐减小,速率也应逐渐减小矛盾。然而事实就是这样。如何从影响反应速率的其他外界因素--压强、温度、催化剂角度去分析呢?从反应本质和反应外界条件来看,压强、催化剂(没加入催化剂)的影 响均可排除。温度的影响是重点和关键。这就要看我们在做实验的时候,是否认真、细心观察所发生的一切现象,并有所感受。若从温度的影响来看肯定是升高了反应体系的温度,且温度升高的影响大于浓度减小的影响,但并没有加热,所以只能是反应本身所产生的热量所致。t2→t3主要是浓度减小占主要影响因素了。
响均可排除。温度的影响是重点和关键。这就要看我们在做实验的时候,是否认真、细心观察所发生的一切现象,并有所感受。若从温度的影响来看肯定是升高了反应体系的温度,且温度升高的影响大于浓度减小的影响,但并没有加热,所以只能是反应本身所产生的热量所致。t2→t3主要是浓度减小占主要影响因素了。
答案:(1)反应放热,溶液温度升高,反应速率加快
随反应进行,盐酸的浓度减小较大,反应速度减慢
(2)Fe3+
氧化性大于H+,所 以锌先与Fe3+ 反应,故氢气量减少
以锌先与Fe3+ 反应,故氢气量减少
(3)正确。实验三:正极:杂质、负极:锌、电解 质溶液:盐酸;实验四:正极:铜、负极:锌、电解质溶液:盐酸。
质溶液:盐酸;实验四:正极:铜、负极:锌、电解质溶液:盐酸。
15.(14分)“西气东输”是西部开发的重点工程,这里的气是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,两者的体积比约为1∶1。已知1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;1
mol氢气完全燃烧生成液态水放出286 k J热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
J热量;1 mol CH4气体完全燃烧生成CO2气体和液态水放出890 kJ热量。
(1)写出氢气完全燃烧生成液态水的热化学反应方程式:_____________________,
若1 mol CH4气体完全燃烧生成CO2气体和水蒸气,放出的热量_______890 kJ(填“>”、“=”或“<”)。
(2)忽略水煤气中其他成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为_______;燃烧生成的CO2的质量比约为_______。
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是___________。


14.(12分)(思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
10.(多选)下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
[解析]选A、C。铜锌原电池中,Zn活泼, 是负极,Cu是正极,A正确。电解精炼粗铜的过程是:粗铜 Cu2+ 精铜,粗铜为阳极,B不正确。电镀铜时:Cu Cu2+ Cu(附着在镀件上),铜作阳极,C正确。电解稀H2SO4制H2、O2时,阳极应该使用惰性电极。若用Cu作阳极,则阳极上Cu失电子:Cu-2e- Cu2+,得不到O2,D不正确。
是负极,Cu是正极,A正确。电解精炼粗铜的过程是:粗铜 Cu2+ 精铜,粗铜为阳极,B不正确。电镀铜时:Cu Cu2+ Cu(附着在镀件上),铜作阳极,C正确。电解稀H2SO4制H2、O2时,阳极应该使用惰性电极。若用Cu作阳极,则阳极上Cu失电子:Cu-2e- Cu2+,得不到O2,D不正确。



[解析]选D。A项,Li从零价升至正价,失去电子,Li作为负极,正确;B项,反应逆向进行时,反应物只有一种,故化合价既有升,又有降,所以既发生氧化反应又发生还原反应,正确;C项,由于Li可以与水反应,故不能用水溶液作电解质溶液,正确。D项,原电池中阳离子应迁移至正极,故错。
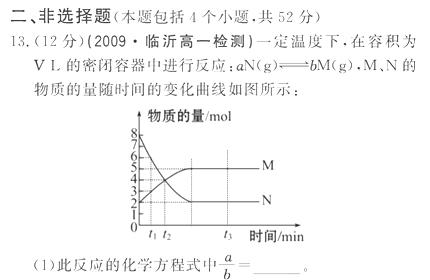
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:_ ___________________。
___________________。
(3)下列叙述能说明上述反应达到平衡状态的是(填序号)
A.反应中M与N的物质的量之比为1︰1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化


9.(2009·全国卷Ⅱ)2H2(g)+O2(g)====2H2O(l)ΔH=-571.6 kJ·mol-1 CH4(g)+2O2(g)====CO2(g)
+2H2O(l) ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ。则原混合气体中H2与CH4的物质的量之比是( )
A.1∶1 B.1∶3 C.1∶4 D.2∶3
[解析]选 B。设H2、CH4的物质的量分别为x、y。则x+y=5,571.6x/2+890y=3
695,解得x=1.25 mol;
B。设H2、CH4的物质的量分别为x、y。则x+y=5,571.6x/2+890y=3
695,解得x=1.25 mol;
y=3.75 mol,两者比为1∶3,故选B项。
7.某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示,对图中曲线的描述正确的是( )
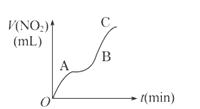
A.OA段表示开始时,反应速率稍慢
B.AB段表示反应速率较快,可能因为产物有催化作用
C.BC段表示反应速率最快,在该时间内收集到的气体最多
D.OC线表示随时间增加,反应速率逐渐增大


6.(2010·福州模拟)将经过酸洗除锈的铁钉,用饱和食盐水浸泡后放入如图所示装置中,下列叙述正确的是
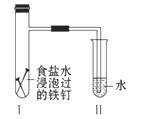
A.过一段时间,Ⅱ试管中的导管内水柱上升
B.Ⅰ试管中铁钉由于发生电解反应而被腐蚀
C.铁钉在该装置中被腐蚀的情况随时间的延长而加快
D.Ⅰ试管中铁钉发生反应的一个电极反应式为:
2Cl--2e-====Cl2↑
[解析]选A。铁钉用饱和食盐水浸泡后,形成原电池,发生吸氧腐蚀。铁作负极,电极反应式为:2Fe-4e-====
2Fe2+,铁中的碳 作正极,电极反应式为:O2+2H2O+4e-====
作正极,电极反应式为:O2+2H2O+4e-====
4OH-,因为试管内的氧气被部分吸收,使试管内压强降低,所以Ⅱ试管中的导管内水柱上升。当铁表面生成铁锈时,可以阻止铁和水、氧气的接触,而且氧气的量越来越少,所以铁钉被腐蚀的情况随时间的延长而逐渐减慢。
4.加热KClO3晶体制取氧气时,可以作为催化剂的正确组合是:①Mn ②MnO2 ③KMnO4 ④K2MnO4 ( )
A.①②③④ B.①②③ C.②③ D.②
[解析]选D。本题很容易错选B,原因是认为在加热时,Mn可以被氧气氧化成MnO2,KMnO4可以分解成MnO2,都可以催化KClO3晶体分解而加快反应速率。但是催化剂在反应 前后质量和化学性质不变。Mn和KMnO4虽然可以加快KClO3晶体的分解速率,但由于它们都变成了MnO2,所以它们并不是催化剂。
前后质量和化学性质不变。Mn和KMnO4虽然可以加快KClO3晶体的分解速率,但由于它们都变成了MnO2,所以它们并不是催化剂。
在判断和使用“催化剂”时,要明确以下内容:
(1)催化剂可以改变化学反应速率,其含义包括两方面:一是加快化学反应速率;二是减慢化学反应速率。
(2)催化剂在化学反应前后质量不变,化学性质不变,但物理性质可能改变(例如形状可能由块状变成粉末状)。
(3)催化剂本身参与化学反应。
(4)催化剂可以改变化学反应速率,但不能改变反应的结果,即如果一个化学反应不能发生,即使加入催化剂也不能发生。
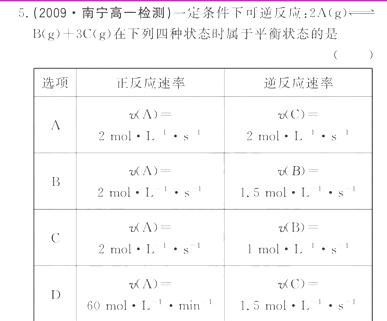
[解析]选C。当反应达到平衡时,正反应速率和逆反应速率相等,即同一种物质的生成速率与分解速率相等。用不同物质表示的反应速率,必须用“化学反应速率之比等于化学计量数之比”换算成同一种物质的反应速率,才能比较。
3.(2010·南京高一检测)将纯锌片 和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述不正确的是(
)
和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述不正确的是(
)
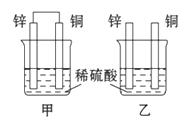
A.两烧杯中锌片均部分溶解
B.甲中铜片是正极,乙中锌片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率乙比甲慢
[解析]选B。本题考查学生对原电池的形成条件,正、负极,电极反应和反应现象的判断能力。乙中未形成闭合电路,不能构成原电池,只是锌直接跟稀硫酸反应。而甲中构成了原电池,铜为正极,锌为负极,产生H2的速率比乙快,因此A、C、D正确,B错误。
2.下列关于化学反应能量变化的说法正确的是( )
A.化学反应中既有物质变化又有能量变化
B.化学键的断裂和形成与反应放热和吸热无关
C.反应物的总能量与生成物的总能量一定相等
D.H2 SO4与NaOH的反应是吸热反应
SO4与NaOH的反应是吸热反应
[解析]选A。化学键断裂时需要吸收热量,而形成化学键时要释放热量,B选项错误;任何一个化学反应中都存在能量变化,所以反应物的总能量与生成物的总能量一定不相等,C选项错误;酸碱中和反应都是放热反应,D选项错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com