
题目列表(包括答案和解析)
5.下列叙述正确的是( )
A.同一主族的元素,原子半径越大,其单质的熔点一 定越高
定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
 [解析]选D。A选项中说法过于武断,如碱金属,原子半径越大,熔点越低;B选项中,同周期元素原子半径越小,越难失去电子;C选项中一般规律如此,但是有些氢化物可以形成氢键,因此产生反常,如HF、H2O和NH3。
[解析]选D。A选项中说法过于武断,如碱金属,原子半径越大,熔点越低;B选项中,同周期元素原子半径越小,越难失去电子;C选项中一般规律如此,但是有些氢化物可以形成氢键,因此产生反常,如HF、H2O和NH3。
4.(2009·广东高考)下列叙述不正确的是( )
A.天 然气和沼气的主要成分是甲烷
然气和沼气的主要成分是甲烷
B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
C.纤维素乙酸 酯、油脂和蛋白质在一定条件下都能水解
酯、油脂和蛋白质在一定条件下都能水解
D.葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物
[解析]选B。天然气、煤道坑气和沼气的主要成分都是甲烷,故A正确;因为是等物质的量的乙醇和乙酸,再根据乙醇和乙酸分子式可知B错;纤维素乙酸酯、油脂和蛋白质都能在一定条件下水解,C正确;葡萄糖属于单糖,分子式为C6H12O6,蔗糖属于糖类中的二糖,分子式为C12H22O11,按照同系物的定义可知D正确。
3.对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是( )
2SO3(g),能增大正反应速率的措施是( )
A.通入大量O2 B.增大容器容积
C.移去部分SO3 D.降低体系温度
[解析]选A。因为通入大量O2,增大了反应物浓度,使正反应速率增大,A正确;增大容器容积,相当于减小体系压强,正、逆反应速率均减小,B错;移去部分SO3,降低了SO3的浓度,正、逆反应速率均减小,C错;降低体系的温度,正、逆反应速率均减小,D错。
2.能源可分为一次能源和二次能源,自然界中以现成形式提供的能源称为一次能源,需依靠其他能源的能量间接制取的能源称为二次能源。据此判断,下列叙述正确的是
( )
A.天然气是二次能源 B.石油是二次能源
C.电能是一次能源 D.水力是一次能源
[解析]选D。根据题干所给一次能源和二次能源的概念可知,天然气、石油、水力都为一次能源,电能是二次能源,所以选D。
1.地球上氦元素主要以 4He形式存在,而月球土壤中吸附着数百万吨 3He,据估算 3He核聚变所释放的能量可供人类使用上万年。下列说法正确的是( )
① 3He、4He的化学性质基本相同
② 3He、4 He具有相同的中子数
He具有相同的中子数
③ 3He核聚变是化学变化
④ 3He液化是物理变化
A.①② B.①④ C.②③ D.③④
[解析]选B。3He和4He质子数相同,中子数不同,互为同位素,它们具有相似的化学性质,但是物理性质略有差别(如质量、密度等不同),所以①正确,②错误;原子是化学变化中的最小微粒,所以化学变化研究的是原子层次上的变化。化学变化前后元素种类不变,原子个数不变,而核聚变原子发生了变化,所以不属于化学变化,③错误;液化是一种状态变化,所以3He液化属于物理变化,
④正确。
16.(4分)(2010·杭州高一检测)工业生产中常利用电解反应来制取新的物质,填写下表中电解各物质时阳极(和电源正极相连的极)、阴极(和电源负极相连的极)所得产物的化学式。

[解析]电解NaCl水溶液,阳极反应式为2Cl--2e- ====Cl2,产生Cl2;阴极反应式为2H+ +2e- ====H2↑,产生H2,由于溶液中的H+ 来自于水的电离,电解过程中随着H+ 浓度的减小,溶液中的OH- 浓度越来越大,所有阴极区产物中还有NaOH;(2)电解氯化铜溶液,阳极反应式为2Cl--2e- ====Cl2↑,产生Cl2;阴极反应式为Cu2+ +2e- ====Cu,产生Cu。
15.(2009·全国卷Ⅰ改造题)下图表示反应X(g)  4Y(g)+Z(g)ΔH<0,在某温度时X的浓度随时间变化的曲线:
4Y(g)+Z(g)ΔH<0,在某温度时X的浓度随时间变化的曲线:
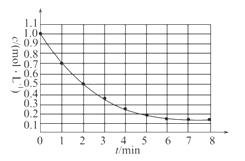
若已知升高温度,平衡向吸热反应方向移动,则下列有关该反应的描述正确的是( )
A.第6 min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v(正)和v(逆)将以同样倍数减小
[解析]选B。A项,6 min时反应达平衡,但未停止,故A项错;B项,X的变化量为1
mol·L-1-0.15 mol ·L-1
·L-1
=0.85 mol·L-1,转化率为0.85/1=85%,B项正确。ΔH<0,反应为放热,故升高温度,平衡将逆向移动,则X的转化率减小,C项错;D项,降温,正、逆反应速率同时减小,但是降温平衡正向移动,故v(正)>v(逆),即逆反应减小的倍数大,D项错误。
第Ⅱ卷(非选择题 共55分)
14.(思维拓展题)不久前,美国一个海军航空站安装了一
台250 kW的MCFC型燃料电池,该电池可同时供应电和水蒸
气,其工作温度为600 ℃-700 ℃,所用燃料为H2,电解
质为熔融的K2CO3,已知该电池的总反应为2H2+O2====2H2O,
负极反应为H2+ 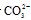 -2e- ====H2O+CO2,则下列推断正确的是( )
-2e- ====H2O+CO2,则下列推断正确的是( )
A.正极反应为:4OH- ====O2+2H2O+ 4e-
4e-
B.放电时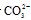 向负极移动
向负极移动
C.电池供应1 mol水蒸气,转移的电子数为4 mol
D.放电时 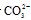 向正极移动
向正极移动
[解析]选B。正极反应为O2+2H2O+4e- ====4OH-,故A错;负极失电子、阴离子移向负极,故B正确,D错误。生成 1 mol H2O转移2 mol电子,故C错。
13.(2009·山东高考)元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
[解析]选B。处于元素周期表金属与非金属分界线附近的元素,既表现金属性,又表现非金属性,A错误;主族元素的最高正化合价等于它所处的主族序数,也等于其最外层电子数,B正确;H+ 、Li+ 的最外层电子分别是0,2,C项错误;同一主族的元素的原子最外层电子数虽相同,但是核电荷数、原子半径不同,化学性质不完全相同,D错误。
12.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )
A.原子半径A<B<C
B.A的氢化物的稳定性大于C的氢化物
C.A的氧化物熔点比B的氧化物高
D.A与C可形成离子化合物
[解析]选B。本题考查学生对原子结构、元素周期律、元素周期表、化学键等基本理论知识的理解与应用。由B原子最外层电子数等于A原子次外层电子数,可推知B原子最外层有2个电子,A为第2周期元素;由A、B、C原子最外层电子数之和为10,A、C同主族可推知A、C原子最外层都有4个电子,再依照A、B、C原子序数递增可推知A是碳元素,B是镁元素,C是硅元素,进而不难判断只有B选项正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com