
题目列表(包括答案和解析)
6.(14分)(2009·南阳高一检测)断开1 mol H-H键,
1 mol N-H键、1 mol N≡N键分别需要吸收的能量为436 kJ、391 kJ、946 kJ,求:
(1)1 mol N2生成NH3需_____ (填“吸收”或“放出”)能量_____ kJ。
(2)1 mol H2生成NH3需_____ (填“吸收”或“放出”)能量_____ kJ。
 [解析]本题可从断键吸收的能量数值与成键放出的能量数值的相对大小来判断,若E(断键)>E(生成),则为吸热反应;E(断键)<E(生成)则为放热反应。
[解析]本题可从断键吸收的能量数值与成键放出的能量数值的相对大小来判断,若E(断键)>E(生成),则为吸热反应;E(断键)<E(生成)则为放热反应。
(1)N2+3H2 2NH3,生成2 mol NH3形成6 mol N-H键
时要放出6 mol×391 kJ/mol=2 346 kJ的能量,拆开
1 mol N≡N键和3 mol H-H键时吸收的总能量为946 kJ+
3 mol×436 kJ/mol=2 254 kJ,整个过程中的能量变化为放出能量,为2 346 kJ-2 254 kJ=92 kJ。

[实验·探究]
5.(思维拓展题)已知25 ℃、101 kPa下,1 mol石墨完全燃烧生成CO2放出393.51 kJ热量、1 mol金刚石完全燃烧生成CO2放出395.41 kJ热量。据此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
[解析]选A。25 ℃、101 kPa下,1 mol石墨完全燃烧生成CO2放出的热量比1 mol金刚石完全燃烧生成CO2放出的热量少395.41 kJ-393.51 kJ=1.9 kJ。也就是说,石墨的能量比金刚石的低,由石墨制备金刚石必须从外界吸收能量,是吸热反应。
4.(2010·保定高一检测)下列图中能正确表示 X+3Y====2Z(放热反应)过程的能量变化的是( )
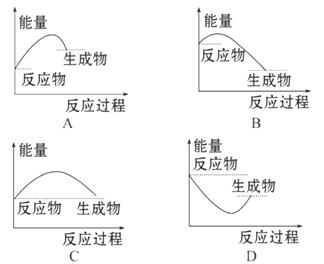
[解析]选B。反应放出能量,会导致生成物的总能量低于反应物的总能量,且反应需加热才能进行,故只有B项正确。
3.下列中和反应中放出热量最多的是( )
A.100 mL 0.3 mol/L的HCl和50 mL 0.3 mol/L的NaOH相混合
B.80 mL 0.3 mol/L的HCl和80 mL 0.3 mol/L的NaOH溶液相混合
C.80 mL 0.3 mol/L的H2SO4和80 mL 0.3 mol/L的NaOH溶液相混合
D.50 mL 0.3 mol/L的H2SO4和50 mL 0.6 mol/L的NaOH溶液相混合
|
 mol、0.024 mol、0.030 mol,即D项产生H2O的量最多,所以放出热量最多。
mol、0.024 mol、0.030 mol,即D项产生H2O的量最多,所以放出热量最多。 2.(2010·邯郸高一检测)研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化。据此判断以下叙述中错误的是( )
A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体 系的能量降低
系的能量降低
B.物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能释放出来
C.氮分子内部存在着很强的共价键,故通常状况下氮气的化学性质很活泼
D.需加热才能发生的反应不一定是吸收能量的反应
[解析]选C。N2内部存在N≡N三键,分子很稳定,化学性质不活泼。
1.已知反应Na2S O4·10H2O Na2SO4·nH2O+(10-n)H2O。 有人将装有芒硝(Na2SO4·
O4·10H2O Na2SO4·nH2O+(10-n)H2O。 有人将装有芒硝(Na2SO4· 10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热使室内保持低温度,晚上把白天所蓄热量放出,使室内保持温暖。以下说法不正确的是( )
10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热使室内保持低温度,晚上把白天所蓄热量放出,使室内保持温暖。以下说法不正确的是( )
A.白天将太阳能转化为化学能
B.白天将化学能转化为太阳能
C.晚上将化学能转化为热能
D.晚上发生的是放热反应
[解析]选B。白天吸收太阳能使Na2SO4·10H2O分解,即太阳能转化为化学能,晚上,Na2SO4·nH2O与(10-n)H2O作用形成Na2SO4·10H2O放出热量,即化学能转化为热能。
16.(15分)乙酸乙酯是无色具有水果香味的液体,沸点77.2 ℃,某同学制取它用冰醋酸14.3 mL,95%的乙醇 23 mL,还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液。主要仪器如图所示。
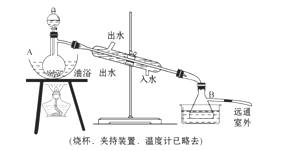
实验步骤是:
①先向A中蒸馏烧瓶注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里两种有机物的物质的量之比约为5∶7。
②加热油浴保温约135 ℃-145 ℃。
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完全。
④保持油浴温度一段时间,至不再有液体流出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批、少量、多次地加到馏出液里,边加边摇荡,至无气泡产生为止。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是_____。
(2)用过量乙醇的主要目的是_____。
(3)用饱和Na2CO3溶液洗涤粗酯的目的是_____。如果用NaOH浓溶液代替Na2CO3溶液将引起的后果是_____。
(4)用饱和CaCl2溶液洗涤粗酯的目的是_____。
(5)为什么操作③要使加料与馏出的速度大致相等?
_______________________。
(6)在⑧所示的粗酯里还含有的杂质是_____。
[解析]在制取乙酸乙酯的实验中浓H2SO4的作用是催化剂和吸水剂。通常加入的乙醇要过量,这样既加快反应速率又有利于平衡向生成乙酸乙酯的方向移动,同样促进平衡正移且提高乙酸的转化率。因乙酸和乙醇均易挥发,所以制取的乙酸乙酯中含有杂质乙酸和乙醇,因饱和Na2CO3溶液能与乙酸反应,溶解乙醇且降低乙酸乙酯的溶解度,因此可用饱和Na2CO3溶液来洗涤粗酯。因浓NaOH能使乙酸乙酯水解,故不能用浓NaOH代替饱和Na2CO3溶液。据信息知饱和CaCl2溶液是吸收粗酯中可能残留的乙醇,这样再分液后得到的粗酯中的杂质就只有水了。
答案:(1)催化剂和吸水剂
(2)促进平衡向生成乙酸乙酯的方向移动,有利于乙酸乙酯的生成
(3)除去乙酸乙酯中的乙酸和乙醇
致使乙酸乙酯水解
(4)除去乙酸乙酯中的乙醇
(5)让产生的乙酸乙酯及时蒸馏出来,使蒸馏烧瓶内压强一定,从而得到平稳的蒸气气流
(6)水
15.(12分)你注意到汽车加油站内的标牌了吗?某些省市加油站提供的汽油标号由90#、93#换成了E90、E93,后者是在汽油中加入了10%的燃料乙醇而制得的乙醇汽油。
燃料乙醇的生产过程由下图表示:
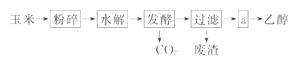
(1)粉碎玉米的目的是_____ 。
(2)生产过程中为了检验淀粉水解是否完全,可使用的试剂是_____ 。
(3)步骤a的操作是_____ 。
A.蒸发 B.萃取 C.蒸馏 D.分液
(4)发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途: _____ 、 _____ 。
(5)以玉米等淀粉原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+nH2O 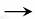 nC6H12O6
nC6H12O6
C6H12O6 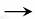 2C2H5OH+2CO2
2C2H5OH+2CO2
根据上述反应式,可以算出100 kg淀粉理论上可生产无水乙醇_____kg。(相对分子质量:C-12 H-1 O-16)
(6)下图是燃料乙醇的生产和消费过程示意图。虽然燃料乙醇的使用缓解了汽车能源的紧张状况,但仍存在一些问题。由此可知,燃料乙醇_____ 。
A.是最理想的绿色能源
B.提供的能量来自于太阳能
C.生产和消费过程对空气没有任何影响
D.生产过程中将消耗大量粮食,以避免粮食过剩
[解析](1)粉碎玉米是增大反应物的接触面积,加快反应速率,提高原料的利用率。
(2)因为淀粉遇I2变蓝,只要有淀粉存在,加I2一定会变蓝,因此可用I2或碘酒来检验淀粉是否完全水解。
(3)滤去滤渣后得到的是水和乙醇的混合溶液,由于水和乙醇互溶,但沸点不同,乙醇的沸点低于水,用蒸馏的方法可使乙醇从混合物中分离出来。
(4)纯度为99%的CO2可以很好的利用,因为CO2可以作碳酸饮料,还可以制干冰,还可以制纯碱或制碳酸钙等。

(6)据图可知,CO2在光合作用下通过植物生成玉米等粮食,通过发酵等生成乙醇,乙醇在汽油中燃烧不产生污染物,但要有光能存在才能循环,也消耗掉大量粮食,消费过程中产生大量的CO2会产生温室效应,故选B。
答案:(1)增大反应物的接触面积,从而提高反应速率(2)I2 (3)C
(4)制饮料 制干冰 制纯碱等(写出两种即可)
(5)56.8 (6)B
3.125∶4.2∶3.644=6∶8∶7。
n(O2)=1.01 L÷22.4 L·mol-1=0.045 mol,1 mol A完全燃烧消耗4.5 mol O2,设A的分子式为(C6H8O7)n,
(C6H8O7)n+4.5O2
 6nCO2+4nH2O,n=1,则A的分子式为C6H8O7。(2)A+3NaHCO3
6nCO2+4nH2O,n=1,则A的分子式为C6H8O7。(2)A+3NaHCO3
 3CO2,A分子中含有3个
3CO2,A分子中含有3个
-COOH;又因为它与乙酸可发生酯化反应,说明A还含有醇羟基,又A分子中含7个氧原子,所以,A分子含1个醇羟基。A分子中含有8个氢,3个-COOH,1个醇羟基(-OH)共占4个氢,所以,还有4个氢与碳原子直接相连,即含2个
-CH2COOH,4个与碳直接相连的氢完全相同,即2个
-CH2COOH处于对称位置;(3)A分子含醇羟基、羧基,脱水方式有:①消去羟基和氢生成碳碳双键;②羧基和羟基脱去水生成酯;③两个羧基脱水生成酸酐。
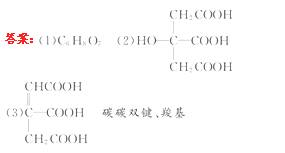
14.(13分)已知化合物A中各元素的质量分数分别为
C:37. 5%,H:4.2%和O:58.3%。请填空:
(1)0.01 mol A在空气中充分燃烧需要消耗氧气1.01 L(标准状况),则A的分子式是_____。
(2)实验表明:A中不含-CHO。1 mol A与足量的碳酸氢钠溶液反应可以放出3 mol二氧化碳。在浓硫酸催化下,A与乙酸可发生酯化反应。A分子中有4个位置相同的氢原子。则A的结构简式是_____ 。
(3)A失去1分子水后形成化合物C,写出C的一种可能的结构简式_____ 。所含官能团名称: _____。
[解析](1)n(C)∶n(H)∶n(O)=(37.5/12)∶(4.2/1)∶(58.3/16)=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com