
题目列表(包括答案和解析)
3.X、Y、Z为三种气体。把a mol X和b mol Y充入一密闭容器中,发生X+2Y 2Z反应,达到平衡时。若它们的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为( )
2Z反应,达到平衡时。若它们的物质的量满足n(X)+n(Y)=n(Z),则Y的转化率为( )
A.[(a+b)/b]×100%
B.[2(a+b)/5b]×100%
C.[2(a+b)/b]×100%
D.[(a+b)/5b]×100%
[解析]选B。设参加反应的Y的物质的量为x。
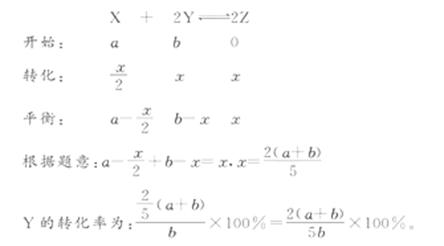
2.(2010·南通高一检测)在一定温度下,可逆反应
X(g)+3Y(g)  2Z(g)达到平衡的标志是( )
2Z(g)达到平衡的标志是( )
A.Z的生成速率是X消耗速率的2倍
B.单位时间生成a mol X,同时生成3a mol Y
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数之比为1∶3∶2
[解析]选C。由化学平衡状态的定义可知,达到化学平衡状态的根本标志是v(正)=v(逆),它可以有各种表现形式。A只表示出了v(正),B只表示出了v(逆),D选项中三种分子数之比与化学方程式中的化学计量数之比相等与化学平衡状态无关。
1.对可逆反应4NH3(g)+5O2(g)  4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
[解析]选A。A项,反应达平衡时,v正(O2)与v逆(NO)
之比等于对应物质的化学计量数比;B项,若单位时间内生成x mol NO,同时生成x mol NH3,表明反应到达平衡;C项,增大容器容积,压强减小,各物质的浓度减小,正、逆反应速率均减小;D项,3v正(NH3)=2v正(H2O)。
8.(14分)如图是某同学利用日常用品注射器设计简易实验装置。甲管中注入10 mL CH4,同温同压下乙管中注入 50 mL Cl2,将乙管气体推入甲管中,气体在甲管中反应,针管用日光照射一段时间。
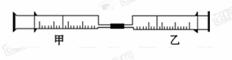
(1)下列是某同学预测的实验现象:
①气体最终变为 无色;②实验过程中,甲管活塞向内移动; ③甲管内壁有油珠;④产生火花。其中正确的是_____ 。
无色;②实验过程中,甲管活塞向内移动; ③甲管内壁有油珠;④产生火花。其中正确的是_____ 。
(2)甲管中发生的化学反应类型为_____ 。
(3)反应后,甲管中剩余气体能用下列试剂吸收的是___。
A.水 B.氢氧化钠溶液
C.硝酸银溶液 D.饱和食盐水
(4)反应后,若将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到_____ ,若再向其中滴入几滴石蕊试液,又观察到_____ 。
[解析]在光照下,甲烷与氯气发生连锁反应:
CH4+Cl2 CH3Cl+HCl,CH3Cl+Cl2
CH3Cl+HCl,CH3Cl+Cl2 CH2Cl2+HCl,
CH2Cl2+HCl,
CH2Cl2+Cl2 CHCl3+HCl,CHCl3+Cl2
CHCl3+HCl,CHCl3+Cl2 CCl4+HCl。
CCl4+HCl。
(1)理论上,甲烷与氯气体积比为1∶4时二者恰好完全反应,而该针管里氯气与甲烷体积比为5∶1>4∶1,说明氯气过量,最终气体中仍有氯气。该反应进行缓慢,不会产生火花。产物中只有氯化氢和一氯甲烷为气体,所以气体的总物质的量减小,内部压强减小,甲管活塞向内移动。(2)甲烷分子中的四个氢原子可被氯原子逐一取代,故甲管中发生的是取代反应。(3)剩余气体中含有氯气和氯化氢,可用氢氧化钠溶液吸收剩 余气体。
余气体。
(4)生成的HCl会与AgNO3反应生成AgCl白色沉淀,同时因CH2Cl2、CHCl3、CCl4难溶 于水而看到液体分为两层,若加入几滴石蕊,溶液会变红。
于水而看到液体分为两层,若加入几滴石蕊,溶液会变红。
答案:(1)②③
(2)取代反应
(3)B
(4)液体分为两层,产生白色沉淀 溶液变红色
7.(9分)(2010·三明高一检测)CH4和O2(过量)混合气体840 mL(标准状况下),经电火花点燃充分反应,将反应后的气体(120 ℃)通过足量碱石灰(充分吸收CO2和H2O) ,碱石灰增重0.60 g。
,碱石灰增重0.60 g。
(1)原混合气体中CH4的物质的量为_______。
(2)通过足量碱石灰后剩余气体的体积为_______ (标准状况下)。
(3)打火机中的燃料是丁烷(C4H10),写出丁烷完全燃烧的化学方程式: _______ 。
[解析]设原混合气体中CH4的物质的量为x,则有
CH4+2O2 CO2+2H2O
CO2+2H2O
X 2x x 2x
所以44 g/mol·x+18 g/mol·2x=0.60 g
解得x=0.007 5 mol,因此原混合气体中CH4与O2的总物质的量为0.007 5 mol×3=0.022 5 mol,即504 mL,所以剩余气体的体积为840 mL-504 mL=336 mL。丁烷分子式为C4H10,完全燃烧产物为CO2和H2O,据原子守恒配平即得化学方程式。
答案:(1)0.007 5 mol (2)336 mL
(3)2C4H10+13O2 8CO2+10H2O
8CO2+10H2O
[实验·探究]
6.(7分)如图,某气体X可能由H2、CO、CH4中的一种或几种组成。将X气体燃烧,把燃烧后生成的气体通过A、B两个洗气瓶。试回答下列问题:
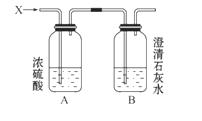
(1)若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是___________。
(2)若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是____________。
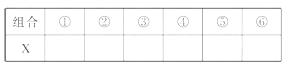
(3)若A,B两个洗气瓶的质量都增加,试推测X可能有几种组合,填写下表。(有多少种写多少种,不必填满)
[解析]H2、CO、CH4燃烧的产物分别是H2O(g)、
CO2(g)、CO2(g)和H2O(g)。H2O(g)可被浓H2SO4吸收,CO2可被澄清石灰水吸收。根据洗气瓶质量的变化,可判定生成的产物 。
。
答案:(1)H2 (2)CO
(3)①CH4 ②CH4与H2 ③CH4与CO
④H2与CO ⑤CH4、H2和CO
5.在标准状况下,22.4 L CH4与氯气在光照下发生取代反应,待反应完全后,测得四种有机取代物的物质的量相等,则消耗的氯气为( )
A.0.5 mol B.2 mol C.2.5 mol D.4 mol
[解析]选C。1 mol  CH4与氯气发生取代反应,生成CH3Cl、CH2Cl2、CHCl3、CCl4各0.25 mol,该四种取代物中n(Cl)=0.25 mol×(1+2+3+4)=2.5 mol,根据取代反应特点,1/2的氯原子进入氯化氢,所以n(HCl)=2.5 mol,故生成物中所含氯原子共2.5 mol+2.5 mol=5
mol,参加反应的氯气为n(Cl2)=2.5 mol。
CH4与氯气发生取代反应,生成CH3Cl、CH2Cl2、CHCl3、CCl4各0.25 mol,该四种取代物中n(Cl)=0.25 mol×(1+2+3+4)=2.5 mol,根据取代反应特点,1/2的氯原子进入氯化氢,所以n(HCl)=2.5 mol,故生成物中所含氯原子共2.5 mol+2.5 mol=5
mol,参加反应的氯气为n(Cl2)=2.5 mol。
4.将标准状况下的11.2 L甲烷和22.4 L氧气混合点燃,恢复到原状况后,气体的体积为( )
A.11.2 L B.22.4 L C.33.6 L D.44.8 L
[解析]选A。CH4+2O2 CO2+2H2O,因此11.2 L甲烷与22.4 L氧气恰好完全反应生成11.2 L的CO2气体,故选A。
点燃
3.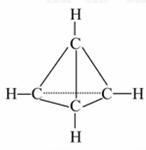 (2010·宣城同步检测)已知一种
(2010·宣城同步检测)已知一种
有机物的分子式为C4H4,分子结构如
图所示,若将该有机物与适量的氯气
混合光照,则生成的卤代烃的种类共
有( )
A.2种 B.4种 C.5种 D.6种
[解析]选B。据C4H4分子结构可知分子中4个碳原子形成正四面体结构,所以分子完全对称,因此C4H3Cl、C4H2Cl2、C4HCl3、C4Cl4分子均只有一种结构,故生成的卤代烃一共有4种。
2.下列叙述错误的是( )
A.通常情况下,甲烷跟强酸、强碱、强氧化剂不起反应
B.甲烷化学性质比较稳定,不能被任何氧化剂氧化
C.甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应
D.甲烷的四种取代物都难溶于水
[解析]选B。CH4的性质比较稳定,通常情况下,不与强酸、强碱、强氧化剂反应,而不是不能被任何氧化剂氧化,A正确,B错误;CH4在光照条件下与Cl2发生 取代反应,生成4种有机产物,它们是CH3Cl、CH2Cl、CHCl3和CCl4,且均难溶于水,故C、D均正确。
取代反应,生成4种有机产物,它们是CH3Cl、CH2Cl、CHCl3和CCl4,且均难溶于水,故C、D均正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com