
题目列表(包括答案和解析)
5.(思维拓展题)将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极,其电极反应式为:CH4+10OH--8e-
==== 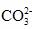
+7H2O;通入氧气的一极,其电极反应式为:2O2+4H2O+8e- ====8OH-,下列叙述正确的是( )
A.通入甲烷的电极为正极
B.正极发生氧化反应
C .该燃料电池总反应为:CH4+2O2+2OH-
====
.该燃料电池总反应为:CH4+2O2+2OH-
==== 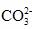 +3H2O
+3H2O
D.在燃料电池工作时,溶液中的阴离子向正极移动
[解析]选C。由题干可知,在反应中CH4失电子作还原剂,所以通入甲烷的电极是原电池的负极,而氧气在反应中得电子,所以通入氧气的电极是原电池的正极;将两个电极反应式按得失电子数相等加合可得电池总反应,在燃料电池工作时,OH- 向负极移动与CH4失电子后的产物结合而得到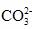 。
。
4.可充电电池因其可以反复使用而深受广大消费者喜爱。请你根据对可充电电池的理解,选出下列有 关说法正确的是( )
关说法正确的是( )
A.放电时,把热能转化为电能
B.放电时,正极发生氧化反应
C.充电时,电池的负极发生还原反应
D.充电时,把化学能转化为电能
[解析]选C。本题重点考查学生对可充电电池充、放电过程的了解。充电和放电是两个相反的过程。放电时,把化学能转化为电能,充电时把电能转化为化学能,A、D均错;放电时,负极发 生氧化反应,正极发生还原反应,充电时负极发生还原反应,而正极发生氧化反应,所以B错C对。
生氧化反应,正极发生还原反应,充电时负极发生还原反应,而正极发生氧化反应,所以B错C对。
3.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电,电池负极反应为( )
A.H2+2OH--2e- ====2H2O
B.O2+4H+ +4e- ====2H2O
C.H2-2e- ====2H+
D.O2+2H2O+4 e-
====4OH-
e-
====4OH-
[解析]选C。由题意知氢气作负极被氧化,由于电解质溶液为H3PO4,所以H2转变为H+。
2.(2010·双鸭山高一检测)根据下列事实:①X+Y2+ ====X2+ +Y;②Z+2H2O(冷)====Z(OH)2+H2↑;③Z2+ 氧化性比X2+ 弱;④由Y、W电极组成的电池,电极反应为W2+ +2e- ====W、Y-2e- ====Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为( )
A.X>Z>Y>W
B.Z> W>X>Y
W>X>Y
C.Z>Y>X>W
D.Z>X>Y>W
[解析]选D。由①知还原性X>Y;由②知Z为第ⅡA族活泼金属;由③知还原性Z>X;由④知,W、Y组成原电池时,Y发生氧化反应做负极,所以还原性Y>W。综上可知还原性由强到弱的顺序为:Z>X>Y>W。
1.(2010·连云港高一 检测)一个原电池的总反应的离子方程式是Zn+Cu2+
====Zn2+
+Cu,该原电池的合理组成是( )
检测)一个原电池的总反应的离子方程式是Zn+Cu2+
====Zn2+
+Cu,该原电池的合理组成是( )
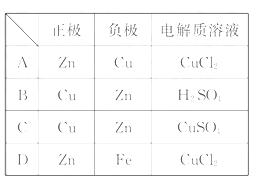
[解析]选C。该原电池的总反应可分为两个电极反应,负极:Zn-2e- ====Zn2+,正极:Cu2+ +2e- ====Cu,因此负极材料应是Zn,电解质溶液应是可溶性铜盐溶液,而正极材料为活动性比Zn弱的导体,如Cu、Fe、Pt、石墨等。
7.(10分)(思维拓展题)把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
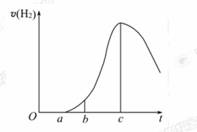
(1)曲线由O→a段不产生氢气的原因是_____;
有关反应的化学方程式为_____ ;
(2)曲线a→c段,产生氢气的速率增加较快的主要原因
_____ ;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因
_____ 。
(4)该反应若使用催化剂,可使H2产量增多吗?
[解析](1)在空气中久置的铝片表面有氧化铝薄膜,硫酸首先和氧化铝反应,所以O→a段不产生H2;
(2)a→c段,虽然硫酸的浓度减小但该反应是放热反应,反应进行中温度逐渐升高,化学反应速率逐渐加快;
(3)曲线c以后,硫酸的浓度减小的太多,成为影响化学反应速率的主要因素,故反应速率逐渐下降。
(4)催化剂只改变速率,不会改变产物的量。
答案:(1)硫酸首先和氧化铝反应,不产生H2
Al2O3+3H2SO4====Al2(SO4)3+3H2O
(2)反应放热,温度升高是影响反应速率的主要因素,使反应速率增大
(3)硫酸的浓度逐渐减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降
(4)不会
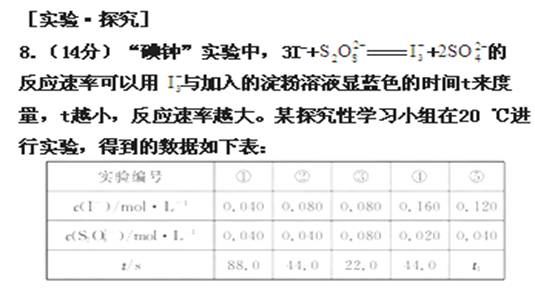 ,
,
回答下列问题:
(1)该实验的目的是_____ 。
(2)显色时间t1= _____ 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t的范围为_____ (填字母)。
A.<22.0 s B.22.0-44.0 s
C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_____。
(5)试思考:若增大压强对该反应速率有何影响?
[解析]本题主要研究反应物I- 与 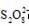 的浓度对反应速率
的浓度对反应速率
的影响;分析表格中的数据与时间t的关系,不难得出:
由①②可知,速率与c(I-)的一次方成正比;由②③可知,
速率与c( 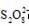 )的一次方成正比;⑤相比①,c(
)的一次方成正比;⑤相比①,c( 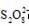 )
)
相同,⑤中c(I-)是①中c(I-)的三倍,故速率应是其三倍,故时间应为其三分之一,即t1=88.0 s÷3=29.3 s;温度越高,反应速率越大,故在40 ℃下进行编号③对应浓度的实验,显色时间t应小于原来的22.0 s,故A项正确;由以上数据不难得出,反应速率与反应物起始浓度乘积成正比或显色时间与反应物起始浓度乘积成反比。(5)该反应没有气体参加,所以不受压强影响。
答案:(1)研究反应物I- 与 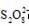 的浓度对反应速率的影响
的浓度对反应速率的影响
(2)29.3 s
(3)A
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
(5)压强对该反应无影响。
6.(6分)某温度时,在2 L容器中
X、Y、Z三种物质随时间的变化曲 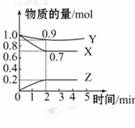
线如图所示,由图中的数据分析,
该反应的化学方程式为______ ,
反应开始至2min时Z的平均反应速
率为______。
[解析]由图中可知2 min内X、Y分别减少了0.3 mol和0.1 mol,Z增加了0.2 mol,故X、Y为反应物,Z为生成物,X、Y、Z的化学计量数之比为3∶1∶2,该反应的化学
5.将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将b g(a>b)粉末状碳酸钙与同浓度的足量盐酸反应(图中虚线所示),则相应的曲线正确的是( )
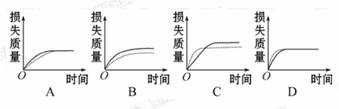
[解析]选C。在化学反应CaCO3+2HCl====CaCl2+CO2↑+H2O中,盐酸是足量的,CaCO3完全反应。CaCO3又分为质量不同和形状不同两种情况。块状CaCO3质量大,放出的CO2多,但速率慢;粉末状CaCO3质量小,放出的CO2少,但速率快。
4.关于A(g)+2B(g)====3C(g)的化学反应,下列该反应速率最大的是( )
A.v(A)=0.6 mol/(L·min)
B.v(B)=1.2 mol/(L·min)
C.v(C)=1.2 mol/(L·min)
D.v(B)=0.03 mol/(L·s)
[解析]选D。该题要特别注意时间单位,D项中时间单位是秒,其他三个选项中时间单位是min。
3.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4====Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
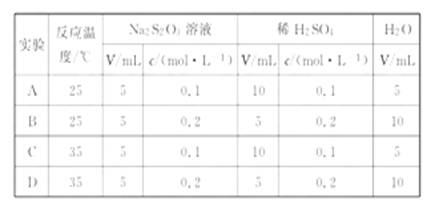
[解析]选D。温度越高,浓度越大,反应速率越快。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com