
题目列表(包括答案和解析)
9.将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液的溶质质量分数为( )
A.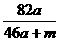 %
B.
%
B.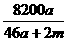 %
%
C.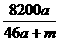 %
D.
%
D.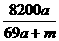 %
%
思路解析:由2Na+2H2O====2NaOH+H2↑,2Al+2NaOH+2H2O====2NaAlO2+3H2↑可知:
2Na - 2NOH-H2↑
a mol
a mol 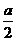 mol
mol
2Al - 2NaOH-2NaAlO2-3H2↑
a mol
a mol a mol 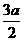 mol
mol
则50a+m-(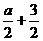 a)×2=46a+m
a)×2=46a+m
w(NaAlO2)=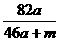 ×100%=
×100%=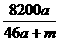 %。
%。
答案:C
8.把一小块钠投入到硫酸铜溶液中,生成物有( )
A.Cu B.Cu(OH)2 C.H2 D.O2
思路解析:钠投入硫酸铜溶液中,先与水反应生成氢氧化钠和氢气,接着氢氧化钠与硫酸铜生成了硫酸钠和氢氧化铜沉淀。
答案:BC
我综合 我发展
7.下列金属在空气中,能自发形成氧化物保护膜的是( )
A.Fe B.Al C.Mg D.Na
思路解析:四种金属在空气中均能自发形成氧化物,但这层氧化物能保护内部金属的只有铝和镁。
答案:BC
6.下列关于化合价的判断正确的是( )
A.Na2O中O元素为-1价 B.Na2O2中O元素为-2价
C.SO2中O元素为-1价 D.SO3中O元素为-2价
思路解析:过氧化钠中氧为-1价;氧化钠、二氧化硫和三氧化硫中氧均为-2价。
答案:D
5.下列关于Na2O和Na2O2的叙述正确的是( )
A.都是白色固体
B.都是碱性氧化物
C.都能和水反应形成强碱溶液
D.都是强氧化剂
思路解析:氧化钠是白色固体、碱性氧化物、和水反应形成强碱;过氧化钠是黄色固体、过氧化物、强氧化剂、溶于水形成强碱。
答案:C
4.金属钠在水中能浮在水面上;在煤油中能沉在油层下。煤油的密度是0.8 g·cm-3,可推测钠的密度(g·cm-3)是( )
A.大于1.0 B.小于0.8
C.介于0.8-1.0之间 D.不能确定
思路解析:金属钠在水中能浮在水面上,说明它的密度比水小,即小于1.0 g·cm-3;在煤油中能沉在油层下,说明它的密度比煤油大,即大于0.8 g·cm-3。
答案:C
3.以下说法错误的是( )
A.钠在常温下就容易被氧化 B.钠受热后能够着火燃烧
C.钠在空气中缓慢氧化能自燃 D.钠在氧气中燃烧更为激烈
思路解析:以上A、B、D三项都是正确的。C项中钠在空气中缓慢氧化也是正确的,但其缓慢氧化过程中并不自燃。
答案:C
2.下列有关钠的物理性质叙述正确的是( )
①银白色金属 ②质软,可以用小刀切割 ③熔点低于100 ℃ ④密度比水小 ⑤热和电的良导体
A.①②④ B.①②③④ C.①③④ D.①②③④⑤
思路解析:各项中钠的物理性质都是正确的。
答案:D
1.下列有关金属元素性质的叙述正确的是( )
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正化合价
C.金属元素在不同化合物中化合价一定是不同的
D.金属元素的单质在常温下均为固体
思路解析:A项中金属元素的原子不能得到电子,只有还原性,但离子中如亚铁离子既可以得到电子被还原,表现氧化性,又可以失去电子被氧化成铁离子,表现还原性;金属元素很多都没有变价,在不同的化合物中的化合价是相同的;金属元素的汞单质在常温下是液体。
答案:B
8.(10分)某研究性学习小组以元素周期律为课题研究“短周期元素在周期表中的分布”,他们提出元素在周期表中排布的四种方案:
(1)元素周期表一
(2)元素周期表二
(3)元素周期表三

(4)元素周期表四

这四种方案都有“合理”的理由,请填写下表:

[解析]关键分析H、He两种元素在不同周期表中的位置,结合H、He两原子的结构特点进行解答。
答案:表一:H元素与碱金属元素原子最外层均为一个电子,He与Ne、Ar等稀有气体最外层都已达稳定结构
表二:He与Be、Mg等第Ⅱ A族的元素,最外层电子数均为2
表三:H与F、Cl等第ⅦA族的元素均可得一个电子形成稳定结构。例如:已制得活泼金属的氢化物(如KH)
表四:H与C、Si等第ⅣA族的非金属元素都不易得到或失去电子形成稳定结构
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com