
题目列表(包括答案和解析)
3.(2010·三明高一检测)下列关于“生活中的化学”的叙述,错误的是( )
A.棉花和蚕丝的主要成分都是纤维素
B.误食重金属盐,可立即喝牛奶或蛋清解毒
C.食用植物油的主要成分是高级脂肪酸甘油酯,它是人体的营养物质
D.新室装潢材料释放出的甲醛等有机物,会污染室内空气
[解析]选A。蚕丝的主要成分是蛋白质,而不是纤维素。
2.蒙古牧民喜欢用银器盛放鲜牛奶,其科学依据是( )
A.溶入的极微量银离子可杀死牛奶中的细菌,防止鲜奶变质
B.可补充人体必需的银元素
C.银易导热牛奶凉得快
D.银的化学性质不活泼,银器坚固耐用
[解析]选A。银属于重金属,其离子能使蛋白质变性,而细菌主要由蛋白质构成,所以Ag+ 能杀菌消毒。
1.下列叙述不正确的是( )
A.蛋白质水解的最终产物是氨基酸
B.所有的蛋白质遇到浓硝酸均变黄
C.人工合成的具有生命活性的蛋白质--结晶牛胰岛素是中国科学家在1965年合成的
D.可以用灼烧法来鉴别蛋白质
[解析]选B。A、C选项都为正确的常识性知识。浓硝酸能使某些蛋白质(分子内含有苯环)变黄,称为蛋白质的颜色反应,但并不是所有的蛋白质遇到浓硝酸都变黄,所以B项不正确。蛋白质在灼烧时有特殊气味,该特征反应常用于鉴别蛋白质,所以D项正确。
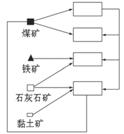
8.(13分)内地某大型铁矿附
近有炼焦煤、石灰石、黏土矿
和丰富的地下水资源。该地区
接近水资源(河流)和铁路干
线,周围是盛产小麦、棉花的
农业地区。根据上述信息,完
成下列填空:
(1)随着大型铁矿的开发,该地将建立焦化厂、钢铁厂、发电厂和水泥厂。请把这4个工厂的名称填入如图的工业联系图空白框内。
(2)为了充分利用当地资源,该地还可能建立的轻工业厂有(写出2个):_____________、_____________等。
(3)写出以焦炭、磁铁矿为主要原料冶炼生铁的化学方程式:① ______________ ,② ______________ ,
③ ______________ 。
[解析]焦化厂、钢铁厂、水泥厂都需要使用电能,根据图中箭头流向,可以判断第一空白框为发电厂。根据钢铁厂需要的主要燃料是焦炭,原料是铁矿石,添加剂是石灰石,所以第三空白框必定为钢铁厂。水泥的原料主要是石灰石、黏土和钢铁厂的废渣, 所以第四空白框为水泥厂,则剩下的第二空白框为焦化厂。由于周围盛产小麦,所以可以建立面粉厂、食品厂;由于周围盛产棉花,所以可以建立棉纺织厂;另外该地区有丰富的地下水资源,还可以建立饮料厂等。这些轻工业部门既可满足市场需求,又可以平衡当地职工的社会需要。
所以第四空白框为水泥厂,则剩下的第二空白框为焦化厂。由于周围盛产小麦,所以可以建立面粉厂、食品厂;由于周围盛产棉花,所以可以建立棉纺织厂;另外该地区有丰富的地下水资源,还可以建立饮料厂等。这些轻工业部门既可满足市场需求,又可以平衡当地职工的社会需要。

7.(7分)(思维拓展题)我国是最早记载丹砂的药用价值和炼制方法的,为了使人们重视丹砂,我国发行了面值为10分的丹砂邮票。丹砂炼汞包括以下两个反应过程:
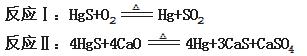
请完成下列问题:
(1)HgS与氧气反应时,氧化剂是_________。
(2)请标出反应Ⅱ中电子转移的方向和数目。
(3)得到的汞中含有铜等杂质,工业上常用5%的硝酸洗涤,写出除去少量铜杂质反应的离子方程式___________
________________________。
[解析](1)在反应HgS+O2 Hg+SO2中,Hg元素的化合价由+2价变成0价,氧元素的化合价由0价变成-2价,化合价降低被还原,所以氧化剂是HgS和O2,还原剂是HgS。(4)要提高
Hg+SO2中,Hg元素的化合价由+2价变成0价,氧元素的化合价由0价变成-2价,化合价降低被还原,所以氧化剂是HgS和O2,还原剂是HgS。(4)要提高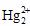 的浓度,可以使平衡正向移动,所以可以增大反应物Hg2+
的浓度。
的浓度,可以使平衡正向移动,所以可以增大反应物Hg2+
的浓度。
答案:(1)HgS和O2

 [实验·探究]
[实验·探究]
6.(10分)随着人类对水的研究不断深入,水的应用也越来越广泛。研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20 ℃、1个大气压下,水可 以结成冰,称为“热冰”。
以结成冰,称为“热冰”。
(1)“热冰”有许多实用价值,如开发新药、用于纳米打印机等,还有可能用来______。
 ①代替干冰 ②建室温溜冰场
①代替干冰 ②建室温溜冰场
③在室温下制作冰雕 ④防止冰川融化
A.①② B.②③ C.③④ D.①④
(2)电解水可以制氢气,化学反应方程式是__________
______ _____。但由于这种方法耗电量大,人们正在研究植物光合作用中光解水的有关机理,以期低成本、高效率地获得
_____。但由于这种方法耗电量大,人们正在研究植物光合作用中光解水的有关机理,以期低成本、高效率地获得 氢气,为此需要重点研究的细胞器是______。
氢气,为此需要重点研究的细胞器是______。
(3)氢能将成为绿色可再生能源。首座燃料电池汽车高压加氢站将于年底现身上海,燃料电池是利用原电池的原理将______能转化为______能。
[解析]“热冰”的特点是在较高温度下使水呈固态,因而可以用于在室温下制作冰制品,建立室温溜冰场,但不具有干冰在室温下汽化的性能,所以不能代替干冰。将冰川变为“热冰”不现实。电解水可生 成H2和O2。原电池是将化学能转化为电能的装置。
成H2和O2。原电池是将化学能转化为电能的装置。
答案:(1)B (2)2H2O  2H2↑+O2↑
叶绿体
2H2↑+O2↑
叶绿体
(3)化学 电
5.正电子、反质子等都属于反粒子,它们跟普通电子、质子的质量、电量相等,但电性相反。科学家设想在宇宙的某些部分可能存在完全由反粒子构成的物质--反物质。欧洲和美国的科研机构先后宣布:他们分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。试推测反氢原子的结构是( )
A.由1个带正电荷的质子与1个带负电荷的电子构成
B.由1个带负电荷的质子与1个带正电荷的电子构成
C.由1个不带电的中子与1个带负电荷的电子构成
D.由1个带负电荷的质子与1个带负电荷的电子构成
[解析]选B。正电子、反质子与电子、质子的区别只是电性相反,则反氢原子与氢原子的区别也只是电性相反,故选B。
4.诺贝尔化学奖获得者艾哈迈德·泽维尔,开创了“飞秒(10-15s)化学”的新领域,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能。你认为该技术不能观察到的是( )
A.化学变化中反应物分子的分解
B.化学反应中原子的运动
C.化学变化中生成物分子的形成
D.原子核的内部结构
[解析]选D。“飞秒化学”运用激光光谱技术能观测化学反应时分子中原子的运动。化学变化中反应物分子的分解和生成物分子的形成,都是原子运动的结果,而原子核的内部结构则不能观测到,选D。
3.下列说法正确的是( )
A.所有的酸性氧化物都能与水反应形成相应的酸
B.所有的酸性氧化物都是非金属氧化物
C.根据电离学说,能电离出H+ 的化合物属于酸
D.Zn+2HCl====ZnCl2+H2↑,体现了HCl的酸性和氧化性
[解析]选D。SiO2不能与水反应形成相应的酸,但SiO2为酸性氧化物,A错误;Mn2O7为金属氧化物,但属于酸性氧化物,B错误;NaHSO4电离出的阳离子为Na+ 和H+,属于酸式盐,C错误;Zn+2HCl====ZnCl2+H2↑,体现了HCl的酸性和氧化性,D正确。
2.(2010·六安高一检测)不同金属的冶炼方法可能不同,主要原因是( )
A.金属在自然界中的分布不同
B.金属在自然界中的含量不同
C.金属在自然界中存在形式不同
D.金属的活泼性不同
[解析]选D。金属采用不同的冶炼方法主要是由金属的活泼性所决定的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com