
题目列表(包括答案和解析)
8.(10分)请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气(氯气有毒,可以用NaOH溶液吸收,氯气可以和碘化钾反应生成碘单质)。
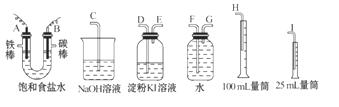
(1)A极发生的电极反应式是___________________,
B极发生的电极反应式是_______________________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:A接______、 ______接______ ;B接______ 、 ______接______ 。
(3)证明产物中有Cl2的实验现象是_________。
(4)已知电解后测得产生的H2的体积为44.8 mL(已经折算成标准状况),电解后溶液的体积 为50 mL,此时溶液中NaOH的物质的量浓度为________。
为50 mL,此时溶液中NaOH的物质的量浓度为________。


7.(11分)(思维拓展题)对图中加以必要的连接并填空:
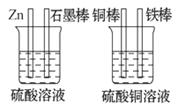 (1)现有如图所示两个烧杯,画
(1)现有如图所示两个烧杯,画
出必要的连线,使连接后的装置能
达到在铁棒上镀上一层铜的目的。
(2)分别写出石墨棒和铜棒的电极反应式:
石墨棒:__________________________;
铜棒: __________________________ ;
(3)若锌减少了6.5 g,则在铁棒上镀上Cu的质量为____________________。
[解析]要达到在铁棒上镀上一层铜的目的,可以将铜棒作为电解池的阳极,将铁棒作为电解池的阴极,即铁、铜和硫酸铜 溶液构成电解池,而锌、石墨棒和稀硫酸构成原电池,锌是负极,和铁棒相连,石墨棒是正极,和铜棒相连。
溶液构成电解池,而锌、石墨棒和稀硫酸构成原电池,锌是负极,和铁棒相连,石墨棒是正极,和铜棒相连。
答案:(1) 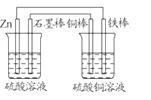
(2)2H+ +2e- ====H2↑ Cu-2 e- ====Cu2+ (3)6.4 g
e- ====Cu2+ (3)6.4 g
[实验·探究]
6.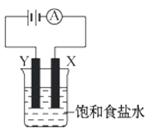 (9分)电解原理在化学工业中有广泛应用。如图表示是一个电解装置,其中盛有饱和食盐水,X、Y是两块石墨电极,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液,请回答以下问题:
(9分)电解原理在化学工业中有广泛应用。如图表示是一个电解装置,其中盛有饱和食盐水,X、Y是两块石墨电极,通过导线与直流电源相连,实验开始时,同时在两边各滴入几滴酚酞试液,请回答以下问题:
(1)在X电极附近溶液中观察到的现象是
___________。
(2)检验Y电极上产物的方法是___________。
(3)电解的化学方程式是___________。
[解析]本题考查的是对电解原理的应用。可以由直流电源的正负极来判断石墨电极上的产物和现象,并且由此得出电解的化学方程式。X电极和直流电源的负极相连,产生氢气,在溶液中产生NaOH,所以酚酞试液变红;Y电极和直流电源的正极相连,产生氯气,可以用湿润的淀粉碘化钾试纸检验。

7.(9分)(思维拓展题)近20年来,对氢能源的研究获得了迅速发展,像电一样,氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二级能源”,而存在于自然界的可以提供现成形式能量的能源称为一级能源,如煤、石油、太阳能和原子能等。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是___________。
A.电解水 B.锌和稀硫酸反应
C.光解海水 D.以石油、天然气为原料

(3)氢能源有可能实现能源的贮存,也有可能实现经济、高效的输送。研究表明过渡金属型氢化物,在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式_____________。

答案:(1)C (2)4.36∶1 (3)PdH0.8
[实验·探究]
6.(9分)太阳能是一种清洁能源,它的利用前景非常诱人。下面是科学家正在研究的一种利用太阳能制取氢气的方法:
(1)首先利用太阳能加热装有氧化锌和木炭的混合物,当反应塔内的温度达到1 200 ℃,可得到高纯度的锌粉。然后将制得的高纯度锌粉与400 ℃以上的水蒸气反应,得到氢气,氧化锌循环使用。请写出该过程涉及到的化学方程式:_____________、 _____________ 。
(2)若投入81 kg氧化锌粉,则理论上制得的氢气在标准状况下的体积为_____________ L。

4.太阳能的开发和利用是21世纪一个重要课题。利用储能介质储存太阳能的原理是:白天在太阳照射下某种盐熔化,吸收热量(盐溶于自身结晶水中),晚间熔盐释放相应的能量,从而使室温得以调节。已知下表数据:
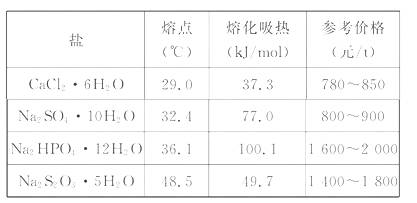
从实际应用,能量利用和经济上综合考虑,最适宜选用作为储能介质的是( )
A.Na2SO4·10H2O B.Na2HPO4·12H2O
C.Na2S2O3·5H2O D.CaCl2·6H2O
[解析]选A。Na2SO4·10H2O和Na2HPO4·12H2O熔化时吸收的热量多,Na2SO4·10H2O俗称芒硝,在自然界中大量存在,价格便宜,故综合考虑Na2SO4·10H2O是最合适的储能材料。

[解析]选C。将三个方程式叠加,可得总的方程式为:2H2O====2H2↑+O2↑,SO2和I2作催化剂,H2SO4是中间产物,H2和O2是产物,即该反应的本质是水的分解,所以
1 mol H2O能制1 mol氢气。
3.(多选)下列有关能量转换的说法正确的是( )
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
[解析]选A、B。煤燃烧放热,是将化学能转化为热能的过程,A选项正确;化石燃料是由植物转变而来的,而植物中的能量是绿色植物通过光合作用从太阳能中获取的, B选项正确;葡萄糖氧化放出热量,将化学能转化为热能,C选项错误;绿色植物的光合作用是将太阳能转化为化学能,D选项错误。
1.下列关于能量转换的认识中,不正确的是( )
A.AgBr见光分解时,主要是光能转化为化学能
B.甲烷燃烧是将全部的化学能转化为热能
C.电池长时间使用会发热,说明部分化学能转变成热能
D.光合作用是将太阳能转化成化学能
[解析]选B。甲烷在氧气中剧烈燃烧,产生淡蓝色火焰,放出大量的热,所以该过程中除了将化学能转化为热能外,还有一部分化学能转化为光能。


[解析]选B。甲烷转化法、水煤气法、碳氢化合物热裂解法都需要消耗传统的能源,电解法耗能大,制取的成本高,这些都不适合作为未来工业上制取氢气的方法。太阳能是已被人类使用的新能源,它数量巨大、时间长久、清洁安全,所以可以研究利用太阳能分解水制氢气;催化剂可以大大加快反应速率,所以可以研究高效催化剂,使水在比较低的温度下分解生成氢气,降低反应的耗能。
8.(10分)为测定一种气态烃A的分子式,取一定量的A置于密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。学生甲、乙设计了如下两个方案,均认为根据自己的方案能求出A的最简式。他们测得的有关数据如下(图中的箭头表示气体的流向,实验前系统内的空气已排除):

试回答:(1)根据两方案,你认为能否求出A分子中的原子个数比?
(2)请根据你选出的方案,通过计算求出A分子中的碳原子和氢原子的原子个数比。
(3)若要确定A的分子式,是否还需要测定其他数据?如果需要,需测定哪些数据?
(4)还可以如何设计方案测定,求A的最简式,写出你的方案。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com