
题目列表(包括答案和解析)
(四)______________________________ 。
(2)框图中加入的试剂①应该是_____ (填“化学式”);加入的试剂②是 _____ (填“化学式”);工业上由无水MgCl2制取镁的化学方程式为: _____。
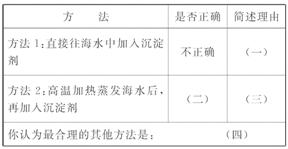
[解析](1)因为海水中Mg2+ 浓度小,直接向海水中加入沉淀剂,必然消耗大量的沉淀剂,浪费原料,方法1不正确;若高温加热蒸发海水,虽然能提高Mg2+ 的浓度,但这样会消耗大量能源,方法2不正确;可以向太阳光蒸发浓缩后的海水中加入沉淀剂,这样既提高了Mg2+ 浓度,又节约能源与原料,最合理。
(2)试剂①的作用是将Mg2+ 沉淀为Mg(OH)2,再结合原料经济方面考虑,试剂①应为Ca(OH)2,试剂②作用是将
Mg(OH)2溶解生成MgCl2,结合不引入新的杂质分析,试剂②应为盐酸。
答案:(1)(一)海水中镁离子浓度小,沉淀剂的用量大,不经济
(二)不正确 (三)能源消耗大,不经济 (四)向太 阳光蒸发浓缩后的海水中,加入沉淀剂(合理均可)
阳光蒸发浓缩后的海水中,加入沉淀剂(合理均可)
(2)Ca(OH)2 HCl
MgCl2(熔融) Mg+Cl2↑
Mg+Cl2↑
(三)_____________________ _________
;
_________
;
(二)______________________________ ;
(一)______________________________ ;
6.(10分)海水中溴元素以Br- 形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:
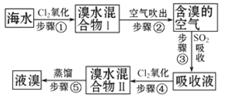
(1)步骤①反应的离子方程式是_____ 。
(2)步骤③反应的化学方程式是_____ ,
从理论上考虑,下列也能吸收Br2的是_____ 。
A.NaO H B.FeCl2 C.Na2SO3 D.H2O
H B.FeCl2 C.Na2SO3 D.H2O
(3)Br的原子序数是_____ ,在周期表中位于第_____
周期_____族。
(4)步骤⑤蒸馏的过程中,温度应控制在80℃-90℃。温度过高或过低都不利于生产,请解释原因________。
(5)为什么不直接用“溴水混合物Ⅰ”而要用“溴水混合物Ⅱ”进行蒸馏得到液溴________。
[解析](1)(2)(3)问相对简单,读懂流程图,结合学过的重点方程式,可以写出2Br- +Cl2====Br2+2Cl-,
SO2+Br2+2H2O====2HBr+H2SO4;只从理论上考虑,NaOH具有
强碱性,能吸收Br2,Fe2+ 、 具有强还原性也能吸收
Br2,但Br2在水中的溶解度较小,不能充分吸收。溴是35号元素,位于第四周期ⅦA族。
(4)温度过高,大量水蒸气随溴排出,溴气中水蒸气的含量增加,温度过低,溴不能完全蒸出,产率太低。
(5)“溴水混合物Ⅰ”中虽然含有溴单质,但浓度低,如果直接蒸馏,处理量大,生产成本高。经过“空气吹出、SO2吸收、氧化”等步骤实际上是将溴水浓缩了。
答案:(1) 2Br- +Cl2====Br2+2Cl-
(2)SO2+Br2+2H2O====2HBr+H2SO4 A、B、C
(3)35 四 ⅦA
(4)若温度过高,大量水蒸气随溴排出,溴气中水蒸气的含量增加,温度过低,溴不能完全蒸出,产率太低
(5)“溴水混合物Ⅰ”中虽然有溴单质,但浓度低,如果直接蒸馏,处理量大,生产成本高,而“溴水混合物Ⅱ”实际上将溴水浓缩了
7.(10分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了如图所示实验:
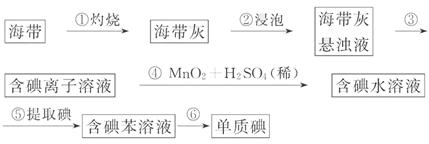
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_____ (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯
F.干燥器
(2)步骤③的实验操作名称是_____ ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_____ 。
(3)步骤④反应的离子方程式是_____ 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是___。
(5)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:_____。
[解析](1)灼烧用到的仪器有:酒精灯、三脚架、泥三角、坩埚、坩埚钳。列出实验仪器的方法是:①从实验装置由下而上;②从实验步骤先后用到顺序列出。(2)物质分离方法是:固液分离用过滤;液液不互溶用分液,液液互溶用蒸馏。(3)利用MnO2的氧化性把I- 氧化。(4)因为苯与水互不相溶,且I2在苯中的溶解度比在水中大,故萃取剂可用苯。
(5)利用I2遇淀粉变蓝的特性来检验。
答案:(1)B、D、E
(2)过滤 蒸馏
(3)2I- +MnO2+4H+ ====Mn2+ +I2+2H2O
(4)苯与水互不相溶,碘在苯中的溶解度比在水中大
(5)取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色(如果变蓝,说明还有单质碘)
[实验·探究]
8.(10分)目前世界上60%的镁是从海水中提取的。学生就这个课题展开了讨论。已知海水提镁的主要步骤如下:
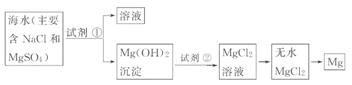
 (1)关于加入试剂①作沉淀剂,同学们提出了不同方法。请你参与他们的讨
(1)关于加入试剂①作沉淀剂,同学们提出了不同方法。请你参与他们的讨 论:
论:
5.(2010·徐州高一检测)下列有关说法中不正确的是
( )
A.工业上可利用海水制取镁
B.实验室可以海带为原料获得碘
C.工业上可用还原剂还原赤铁矿(含Fe2O3)获得铁
D.从海水中提取溴元素(以Br- 形式存在),可以考虑向其中通入F2
[解析]选D。海水中含大量Mg2+,海带中含碘元素,因此工业上可利用海水制镁,实验室中用海带制碘,A、B正确;赤铁矿主要成分为Fe2O3,可用还原剂如焦炭还原Fe2O3获得铁,C正确;因F2能与水剧烈反应,反应方程式为:2F2+2H2O====4HF+O2,因此D错误。
4.下列说法中不正确的是( )
A.海洋是一个远未完全开发的巨大化学资源宝库
B.海水中金的储存量约为陆地的170倍,但它的富集程度却很低
C.从海水中可以提取铀和重水等核原料
D.海水中的溴、氟等元素均为微量元素,但仍有提取的价值
[解析]选D。海水中金元素的储量为5×107t,但1 t海水中的含量仅为4×10-6 g,所以说它的富集程度很低,海洋是一个远未完全开发的巨大化学资源宝库,另外还可从海水中提取铀和重水等核原料,这对一个国家来说具有战略意义,故A、B、C正确;海水中的Br、F等元素为常量元素,D错误。
3.(多选)下列说法错误的是( )
A.从海水中提取食盐可采用结晶的方法
B.从海水中提取溴时,需控制海水呈酸性
C.饱和溴水中通入空气,溴水的浓度不变
D.实验室用石灰石和浓盐酸反应制备CO2
[解析]选C、D。利用海 水结晶可以获得食盐,A正确;因为溴水呈酸性,故从海水中提取溴时需控制海水呈酸性,B正确;因为溴易挥发,因此向饱和溴水中通入空气,会将溴蒸气吹出,使溴水浓度减小,C错误;实验室制CO2应用CaCO3与稀盐酸制CO2,若用浓盐酸会使CO2中含较多的HCl,D错误。
水结晶可以获得食盐,A正确;因为溴水呈酸性,故从海水中提取溴时需控制海水呈酸性,B正确;因为溴易挥发,因此向饱和溴水中通入空气,会将溴蒸气吹出,使溴水浓度减小,C错误;实验室制CO2应用CaCO3与稀盐酸制CO2,若用浓盐酸会使CO2中含较多的HCl,D错误。
2.下列各组元素中既包括海水中的常量元素,又包括海水中的微量元素的是( )
A.Cl、Na、C、F
B.S、Ca、U、I
C.B、F、H、Sr
D.Cl、Na、O
[解析]选B。海水中的H、O、Cl、Na、K、Mg、Ca、S、C、F、B、Br、Sr称为常量元素,其他称为微量元素。故A、C、D三组全部为常量元素,故选B。
1.(2010·临沂高一检测)许多国家十分重视海水资源的综合利用,不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
[解析]选D。题目中A、B、C中物质只能通过化学变化取得,食盐可以通过海水的蒸发结晶得到,淡水可以通过蒸馏获得。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com