
题目列表(包括答案和解析)
4.下列有关气体体积的叙述正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1 mol任何气体所占的体积约为22.4 L
思路解析:影响气体体积大小的因素主要有三个大的方面,一是分子之间的距离(又由温度和压强来决定);二是分子数的多少,也即气体的物质的量的大小;三是气体分子自身的大小,这个因素与前两个因素相比,往往被忽略不计,因为其大小与前两个因素相比是微不足道的。气体摩尔体积则是在一定条件下,1 mol气体所占有的体积,其中标准状况时约为22.4 L·mol-1,常温常压时则约为24.0 L·mol-1。
答案:B
3.实验室里需用480 mL 0.1 mol·L-1的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68 g硫酸铜,加入500 mL水 B.称取12.0 g胆矾配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水 D.称取12.5 g胆矾配成500 mL溶液
思路解析:首先计算所需溶质的质量:0.5 L×0.1 mol·L-1×160 g·mol-1=8 g;如果是胆矾晶体,则应称取晶体的质量为0.5 L×0.1 mol·L-1×250 g·mol-1=12.5 g时所含的溶质的质量才满足溶液配制的要求;配制500 mL溶液,加入水的量就不是500 mL了。
答案:D
2.若50滴水正好是m mL,则1滴水所含的分子数是( )
A.m×50×18×6.02×1023
B.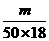 ×6.02×1023
×6.02×1023
C. ×6.02×1023
D.
×6.02×1023
D.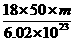
思路解析:m mL水的质量就是m g,其中所含水的物质的量为 mol,1滴水所含的水的物质的量为
mol,1滴水所含的水的物质的量为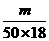 mol,其中的水分子个数则为
mol,其中的水分子个数则为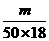 ×6.02×1023。
×6.02×1023。
答案:B
1.若某原子的摩尔质量是M g·mol-1,则一个该原子的真实质量是( )
A.M g
B.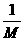 g
C.
g
C.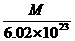 g
D.
g
D.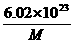 g
g
思路解析:摩尔质量与相对原子质量及1摩尔原子质量数值相等,所以1摩尔原子的质量为M g,而1摩尔原子中含有原子的数目为6.02×1023个,所以1个原子的质量就为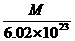 g。
g。
答案:C
7.(16分)某学校化学兴趣小组为探索金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),其实验方案如下:
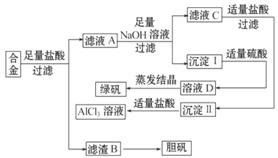
请回答下列问题:
(1)过滤用的玻璃仪器有_____ 。
(2)小组成员经过检测,发现制得的绿矾不纯,试分析原因:_____ ,要想由沉淀Ⅰ最终制得纯度较高的绿矾,应如何改进:  _____
。
_____
。
(3)小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣B中加入稀硫酸和H2O2可以使B溶解,则该反应的化学方程式为_____ 。
(4)有同学提出可将方案中最初溶解合金的盐酸改用烧碱,重新设计方案,也能最终制得三种物质,你认为后得方案相对于前方案_____ (填“更合理”或“不合理”),理由是_____ 。
[解析](1)过滤属于基本操作,玻璃仪器有烧杯、漏斗、玻璃棒。
(2)Fe2+ 很容易被空气中的氧气氧化为Fe3+,加入足量铁粉于溶液中,就可以使Fe3+ 转化为Fe2+,从而使滤液蒸发结晶即可得绿矾。
(3)稀H2SO4不能直接氧化Cu,加入氧化性的 H2O2可氧化。
H2O2可氧化。
(4)实验评价在于比较,一般是从试剂成本、反应时间(生产效率)等方面思考,故后者更合理。
答案:(1)烧杯、漏斗、玻璃棒
(2)反应过程中部分二价铁转化成了三价铁 向溶液D中加入足量铁粉,反应后过滤,取滤液蒸发结晶即可得绿矾
(3)Cu+H2O2+H2SO4====CuSO4+2H2O
(4)更合理 因为前一种方案操作步骤多、时间长、消耗试剂量过大
6.(14分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物。
(1)冶炼铜的反应为
8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
_____ (填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是_____ (填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
高温
(3 )利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
根据以上信息回答下列问题:
a.除去Al3+ 的离子方程式是_____ 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液
NaOH溶液 碘水
所选试剂为___。证明炉渣中含有FeO的实验现象为___。

具有强还原性 ,因此,可以使高锰酸钾溶液褪色。选用的试剂是稀硫酸和高锰酸钾溶液。
,因此,可以使高锰酸钾溶液褪色。选用的试剂是稀硫酸和高锰酸钾溶液。
答案:(1)Cu、O (2)b、c (3)a.Al3+
+4OH-
====  +2H2O b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
+2H2O b.稀硫酸、KMnO4溶液 稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
[实验·探究]
4.下列说法错误的是( )
A.回收照相业中的定影液可提取镁
B.回收不锈钢可提取铬或镍以及铁
C.回收可口可乐易拉罐可回收铝
D.回收精炼铜的阳极泥可得金、银等贵重金属
[解析]选A。本题主要考查生活中常见物质的组成元素。不锈钢的主要成分是铁,并含有少量碳、铬、镍;易拉罐为铝制品;而阳极泥中则含有金、银等杂质,故B、C、D都正确。照相底片上涂有AgBr,故从定影液中可提取银而不是镁。
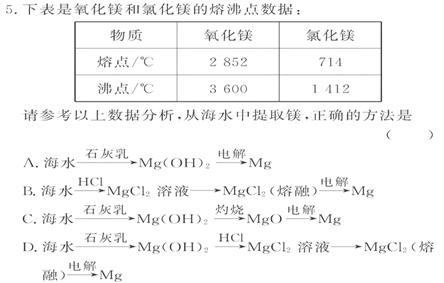
[解析]选D。 海水中Mg2+ 浓度比较低,首先要完成对Mg2+
的富集(用石灰乳使Mg2+ 变为沉淀)。MgO的熔沸点远高于MgCl2,故电解MgO要比电解MgCl2更耗能。
海水中Mg2+ 浓度比较低,首先要完成对Mg2+
的富集(用石灰乳使Mg2+ 变为沉淀)。MgO的熔沸点远高于MgCl2,故电解MgO要比电解MgCl2更耗能。
3.(2010·朝阳区高一检测)下表中金属的冶炼原理 与方法不完全正确的是( )
与方法不完全正确的是( )
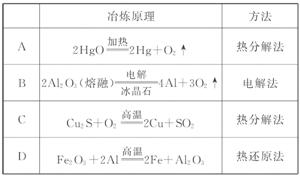
[解析]选C。活泼金属K、Ca、Na、Mg、Al等用电解法冶炼,中等活泼金属Zn、Fe、Sn、Pb、Cu等用热还原法冶炼,不活泼金属Hg、Ag利用热分解法冶炼,故A、B、D正确,C错误。
2.下列说法不正确的是( )
A.自然界中不存在游离态的金属单质
B.金属活动性不同,冶炼方法也有所不同
C.地球上金属矿物资源是有限的,因此,应提高金属矿物的利用率
D.废旧金属的回收利用,有利于环境保护
[解析]选A。自然界中的金属绝大多数以化合态形式存在,极少数金属如Au、Pt等以游离态存在,A错误;金属活动性不同,金属阳离子被还原的难易程度不同,冶炼方法不同,B正确;金属资源是有限的,既要提高金属矿物的利用率,又要回收利用 废旧金属,C、D正确。
废旧金属,C、D正确。
1.(多选)下列物质在冶炼过程中,需加入还原剂的是( )
A.HgO B.Al2O3
C.Fe2O3 D.CuSO4
[解析]选C、D。在冶炼金属的方法中,只有热还原法需要加入还原剂。这种方法适合冶炼金属活动性顺序表中间部分的金属如Fe、Cu,而后面的金属如Hg适合用热分解法,前面的金属如Al适合用电解法。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com