
题目列表(包括答案和解析)
14.配制0.25 mol·L-1的NaOH溶液100 mL,某学生操作如下:
①用托盘天平称出1.00 g氢氧化钠,将天平调好零点,再在两盘上各放一张同样质量的纸,把游码调到1.00 g的位置上,于左盘放粒状氢氧化钠至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸;
②把称好的氢氧化钠放入一只100 mL的烧杯中,加入约10 mL水,搅拌使之溶解,溶解后立即用玻璃棒引流,将溶液移至一只100 mL的容量瓶内,加水至离刻度线约2 cm处,用滴管加水至刻度线;
③写出一个标有配制日期的“0.25 mol·L-1 NaOH溶液”的标签,贴在容量瓶上密闭保存。
指出上述操作中的7处错误:
(1)_________________________________________________________________________。
(2)_________________________________________________________________________。
(3)_________________________________________________________________________。
(4)_________________________________________________________________________。
(5)_________________________________________________________________________。
(6)_________________________________________________________________________。
(7)_________________________________________________________________________。
思路解析:根据天平、容量瓶、溶解及一定物质的量浓度溶液的配制等实验基本操作的要求,结合自己在化学实验中的亲身实践,即可得出答案。
答案:(1)NaOH应放在干燥的烧杯中称量
(2)用过的游码未拨回原处
(3)托盘天平只能称出0.1-0.2 g,称不出1.00 g
(4)烧杯和玻璃棒未洗涤,洗涤液亦应转入容量瓶
(5)溶解NaOH应冷却后再转移至容量瓶中
(6)容量瓶中的溶液未摇匀
(7)配好的溶液应及时转移到有胶塞的试剂瓶内
我创新 我超越
13.(2010北京高考理综,6)下列说法正确的是( )
A.200 mL 1 mol·L-1 Al2(SO4)3溶液中,Al3+和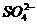 离子总数为6.02×1023
离子总数为6.02×1023
B.标准状况下,22.4 L Cl2和HCl的混合气体中含分子总数为2×6.02×1023
C.0.1 mol 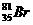 原子中含中子数为3.5×6.02×1023
原子中含中子数为3.5×6.02×1023
D.30 g甲醛中含共用电子对总数为4×6.02×1023
思路解析:Al2(SO4)3在水中发生水解,所以200 mL 1 mol·L-1 Al2(SO4)3溶液中Al3+和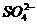 总数小于6.02×1023;标准状况下22.4 L Cl2和HCl混合气体(1 mol)中分子总数为6.02×1023;
总数小于6.02×1023;标准状况下22.4 L Cl2和HCl混合气体(1 mol)中分子总数为6.02×1023;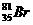 原子里中子数为81-35=46个,所以0.1 mol该原子含中子数4.6×6.02×1023个;每分子甲醛
原子里中子数为81-35=46个,所以0.1 mol该原子含中子数4.6×6.02×1023个;每分子甲醛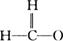 中有4对共用电子,所以30 g甲醛(1 mol)含共用电子对4×6.02×1023。
中有4对共用电子,所以30 g甲醛(1 mol)含共用电子对4×6.02×1023。
答案:D
12.n mol N2和n mol14CO相比较,下列叙述正确的是( )
A.在同温同压下体积相等 B.在同温同压下密度相等
C.在标准状况下质量相等 D.分子数相等
思路解析:物质的量相同的氮气与一氧化碳分子数肯定相等,在同温同压下的体积也是相等的;但N2与14CO的摩尔质量分别为28 g·mol-1和30 g·mol-1,所以它们的密度不同,质量也不等(与是否在标准状况下无关)。
答案:AD
11.将红磷与氯气按1∶1.8的物质的量的比混合,点燃使其充分燃烧,发生如下反应:2P+3Cl2====2PCl3、PCl3+Cl2====PCl5,完全反应后氯气没有剩余,则生成物中三氯化磷与五氯化磷的物质的量之比为?____________。
思路解析:首先将已知条件具体化:假定红磷与氯气的质量各为1 g和1.8 g;设三氯化磷和五氯化磷的物质的量分别为x和y,再根据氯原子与磷原子守恒则有:
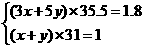
解得:x=0.226 mol,y=0.097 mol,比值为7∶3。
答案:7∶3
10.(2010全国高考理综Ⅰ,8)已知Q与R的摩尔质量之比为9∶22,在反应X+2Y====2Q+R中,当1.6 g X与Y完全反应后,生成4.4 g R,则参与反应的Y和生成物Q的质量之比为( )
A.46∶9 B.32∶9 C.23∶9 D.16∶9
思路解析:设Q与R的摩尔质量分别为9a和22a,根据化学方程式X+2Y====2Q+R生成4.4 g R的同时必然生成3.6 g Q,根据质量守恒定律参加反应Y的质量是6.4 g,所以参与反应的Y和生成物Q的质量之比为16∶9。
答案:D
9.同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是( )
A.密度比为16∶11 B.密度比为11∶16
C.体积比为16∶11 D.体积比为11∶16
思路解析:SO2与CO2的摩尔质量分别为64 g·mol-1及44 g·mol-1,所以等质量的它们的物质的量之比与体积比(相同状态下)即为:44∶64=11∶16;而根据ρ=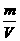 ,则其密度比应与体积比相反为16∶11。
,则其密度比应与体积比相反为16∶11。
答案:AD
8.下列说法不正确的是( )
A.磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.32 g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积只是11.2 L
思路解析:本题是有关物质的量的计算的知识点的综合。A项中磷酸的摩尔质量与1摩尔(6.02×1023个磷酸分子)磷酸分子的质量在数值上是相等的;B项中氮分子与氢分子均为1摩尔,所以它们的质量比为28∶2=14∶1;C项中32 g氧气的物质的量为1摩尔,则氧原子的物质的量为2摩尔,所以氧原子的数目为2×6.02×1023个;D项中常温下气体的摩尔体积不是22.4 L·mol-1,而是24.0 L·mol-1。
答案:D
7.(2010全国高考理综Ⅰ,8)用NA代表阿伏加德罗常数,下列说法正确的是( )
A.0.5 mol Al与足量盐酸反应转移电子数为1NA
B.标准状况下,11.2 L SO3所含的分子数为0.5NA
C.0.1 mol CH4所含的电子数为1NA
D.46 g NO2和N2O4的混合物含有的分子数为1NA
思路解析:A反应中Al变成Al3+,0.5 mol Al反应共转移1.5 mol电子;B中SO3在标准状况下为固体,其摩尔体积不等于22.4 L·mol-1;每个CH4分子含电子:6+1×4=10,0.1 mol CH4含电子1 mol即NA个;1 mol NO2的质量为46 g,根据“质量守恒”,发生2NO2N2O4后得到混合物的质量为46 g,但物质的量小于1 mol,即46 g NO2、N2O4的混合物含有的分子数小于NA。
答案:C
我综合 我发展
6.有一真空瓶质量为m1,该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3。则A的相对分子质量是( )
A.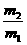 ×29
B.
×29
B.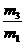 ×29
×29
C.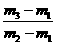 ×29
D.
×29
D.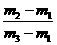 ×29
×29
思路解析:空气的质量为(m2-m1)g,A气体的质量则为(m3-m1)g;相同状况下,容积相等(同一容器)则其物质的量也相等,即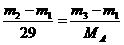 ,则MA=
,则MA=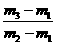 ×29。
×29。
答案:C
5.在标准状况下,若V L甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为( )
A.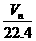 B.
B.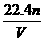 C.
C.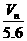 D.
D.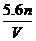
思路解析:标准状况下,V L甲烷的物质的量为 ,其中的甲烷分子数为
,其中的甲烷分子数为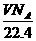 ,其中氢原子则为4×
,其中氢原子则为4×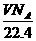 ,即4×
,即4×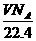 =n,即NA=
=n,即NA=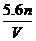 。
。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com