
题目列表(包括答案和解析)
3.在相同条件下,下列燃料中,燃烧产生的污染程度较低的是( )
A.木柴 B.石油 C .煤 D.乙醇
解析:燃料燃烧是否产生污染或污染程度大小,要看燃料燃烧时是否产生有毒气体、烟尘及产生的多少。根据木柴、石油、煤、乙醇的成分,显然乙醇是清洁的燃料,因为燃烧只生成CO2和H2O。
答案:D
2.下列物质不属于“城市空气质量日报”报道内容的是( )
A.二氧化硫 B.氮氧化合物
C.二氧化碳 D.悬浮颗粒
解析:属于大气污染物的是:二氧化硫、氮氧化合物、悬浮颗粒,其含量的多少关系空气的质量和城市居民的生活,是“城市空气质量日报”报道的内容。二氧化碳是空气的成分之一,含量变化只会引起“温室效应”,对空气质量影响不大,不属于报道的内容。
答案:C
1.“酸雨”的形成主要是由于( )
A.森林遭乱砍滥伐,破坏了生态平衡
B.工业上大量燃烧含硫燃料
C.大气中二氧化碳的含量增多
D.汽车排出大量尾气
解析:空气中硫的氧化物和氮的氧化物随雨水降下就成为酸雨。酸雨的形成的主要是由于空气中SO2和NO的增多,在我国主要是SO2的增多。空气中SO2的主要
①化石燃料的燃烧;②含硫矿石的冶炼;③硫酸、磷肥、纸浆厂的工业废气。
由于汽车燃用的汽油、柴油等都已经过脱硫处理,所以形成酸雨的原因是:工业上大量燃烧含硫燃料。
答案:B
14.分离硫粉和铁粉混合物的方法很多,加热升华、用磁铁分离、溶于水过滤、溶于盐酸后过滤等,设计一种最适宜方法分离硫粉和铁粉混合物。
解答:分离物质不仅要利用物质性质的差异将它们区分开,而且要将它们分离后还原成原来的成分及状态。加热后硫升华为硫蒸气逸出,但剩下的铁粉也会在加热时被空气中的氧气氧化;硫粉和铁粉都不能溶于水,若改成溶于二硫化碳后过滤则可,但需将二硫化碳溶液中的硫粉重新还原则仍需要蒸发溶剂;硫粉不溶于盐酸,铁粉能溶解,过滤后滤渣为硫粉,而滤液中是亚铁盐,仍需采用还原剂将其还原为铁。综上所述,只有用磁铁分离最简单。
13.某课外活动小组收集了一种合金进行研究。
(1)外观暗灰色,表皮光滑。
(2)在酒精灯上灼烧,火焰呈绿色;合金片熔化,但不滴落。
(3)取刮去表皮的金属10.0 g,放入足量H2SO4中,收集到标准状况下的H2 9.96 L。
(4)另取刮去表皮的金属10.0 g,放入足量NaOH(aq)中,也收集到标准状况下的H2 9.96 L。
试据此判断,合金中一定含有的元素是__________(写元素符号);下列元素可能含有的是__________(填选项编号)。
a.Ag b.Mg c.Na d.Fe
如果该合金中只含两种元素,它们的质量比是______________________________。
思路解析:焰色反应呈绿色,表明此合金中含有铜。相等质量的合金分别与H2SO4(aq)或NaOH(aq)反应,放出等体积的H2,表明该合金中含有两性金属铝,且不再含有比铜活泼的金属,否则与酸反应放出的H2多。
2Al - 3H2↑
54 g 67.2 L
m(Al) 9.96 L
m(Al)=8.00 g,则m(Cu)=10.0 g-8.00 g=2.0 g
m(Cu)∶m(Al)=1∶4
答案:Cu、Al a m(Cu)∶m(Al)=1∶4
我创新 我超越
12.某课外活动小组将1.100 g碳素钢钢样在纯氧中完全燃烧,生成的CO2通入足量NaOH(aq)中,NaOH(aq)增重0.013 g。求此钢样中碳的质量分数,并判断这种钢是何种钢。
思路解析:钢样燃烧,C单质变为CO2,可被NaOH吸收。(Fe单质变为Fe3O4)
C+O2 CO2 2NaOH+CO2====Na2CO3+H2O
CO2 2NaOH+CO2====Na2CO3+H2O
故NaOH(aq)增加的质量就是生成的CO2的质量。则
C - CO2
12 44
m(C) 0.013 g
m(C)可求,余下的就容易解了。
答案:0.32% 中碳钢
11.将10.0 g铁碳合金放入氧气中高温灼烧,反应后的气体通入过量石灰水中得到1.4 g沉淀,则此铁碳合金是( )
A.生铁 B.高碳钢 C.中碳钢 D.低碳钢
思路解析:根据C原子守恒得:
C-CO2-CaCO3
12 100
m(C) 1.4 g
m(C)=0.168 g w(C)=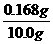 ×100%=1.68%。含量在0.6%-2%之间,是高碳钢。
×100%=1.68%。含量在0.6%-2%之间,是高碳钢。
答案:B
10.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu====2FeCl2+CuCl2。向盛氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
思路解析:铁粉可与氯化铁和氯化铜反应,铜粉只与氯化铁反应。若铁粉过量,则铜粉肯定过量;铁粉不过量,铜则可能过量,也可能不过量;但铁过量而铜不过量的情况是不可能出现的。
答案:B
9.我国在春秋战国时期就懂得将白口铁(含碳量>2%)经淬火热处理得到相当于铸钢的器物(如锋利的宝剑),这一技术要比欧洲早近两千年。白口铁淬火热处理的主要作用是( )
A.除硫、磷杂质 B.适当降低了含碳量
C.掺进合金元素 D.改善表面的结构性质
思路解析:钢比铁的含碳量要低,从“经淬火热处理得到相当于铸钢的器物”中即可知主要作用是降低合金的含碳量。
答案:B
8.纯铁的熔点为1 535 ℃,而高炉中炼铁时生铁(含碳量较高的铁合金)在1 200 ℃左右就熔化了,这是因为( )
A.铁的纯度越高,熔点越低 B.合金的熔点比其成分物质的熔点高
C.形成了铁碳合金,所以熔点变低 D.在高炉中熔化的过程发生了化学反应
思路解析:铁合金的熔点比成分金属或非金属的熔点都要低。
答案:C
我综合 我发展
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com