
题目列表(包括答案和解析)
1.用化学方程式表示下列反应,并注明反应属于四种基本反应类型中的哪一种。
(1)三氧化硫跟水反应
(2)加热高锰酸钾制氧气
(3)氧化铁跟盐酸反应
(4)氧化铜跟铝在高温下生成氧化铝和铜
思路解析:基本反应类型是按反应物及生成物的基本形式来分类的,多种反应物生成一种产物为化合反应,反之为分解反应;一种单质与一种化合物反应生成一种新的单质和一种新的化合物称为置换反应,在溶液中离子间交换的反应则是复分解反应。
答案:(1)SO3+H2OH2SO4(化合反应)
(2)2KMnO4 K2MnO4+MnO2+O2↑(分解反应)
K2MnO4+MnO2+O2↑(分解反应)
(3)Fe2O3+6HCl2FeCl3+3H2O(复分解反应)
(4)3CuO+2Al Al2O3+3Cu(置换反应)
Al2O3+3Cu(置换反应)
15.某学生课外活动小组利用如图所示装置分别做如下实验:
图4-12
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是__________溶液;加热时溶液由红色逐渐变浅的原因是__________________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是___________溶液;加热时溶液由无色变为红色的原因是____________________________。
答案:(1)稀氨水和酚酞 稀氨水中的NH3逸出,所以溶液的颜色变浅
(2)溶有SO2的品红 SO2气体逸出,品红溶液恢复红色
14.根据下列变化进行推断,且已知强热A产生的气态物质的平均相对分子质量为26.3。
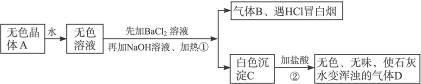
图4-11
(1)推断A、B、C、D的化学式:A__________,B____________,C__________,D__________。
(2)写出①②变化的离子方程式:
①____________________________________;②_____________________________________。
思路解析:(逆推法)由气体B遇HCl冒白烟,可知B为NH3。D能使澄清石灰水变浑浊,为CO2,则逆推知C中含有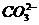 (或
(或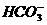 ),结合C是在BaCl2条件下生成的白色沉淀知C为BaCO3。
),结合C是在BaCl2条件下生成的白色沉淀知C为BaCO3。
结合A强热产生的气体的平均相对分子质量为26.3,由B、C逆推可知A为NH4HCO3。
答案:(1)NH4HCO3 NH3 BaCO3 CO2
(2)①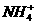 +
+ +Ba2++2OH-
+Ba2++2OH- NH3↑+BaCO3↓+2H2O
NH3↑+BaCO3↓+2H2O
②BaCO3+2H+====Ba2++CO2↑+H2O
我创新 我超越
13.(1)浓硫酸与木炭粉在加热条件下的化学方程式为________________________________。
(2)已知KMnO4酸性溶液可以吸收SO2,试用下图中各装置设计一个实验,验证上述反应所产生的各种产物。
这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):
__________________→__________________→__________________→__________________。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是________________________________________________________________________,B瓶溶液的作用是___________________________________________________________________,C瓶溶液的作用是_________________________________________________________________。
(4)装置②中所加的固体药品是,可确证的产物是,确定装置②在整套装置中位置的理由是_______________________________________________________________________________。
(5)装置③中所盛溶液是__________________,可验证的产物是__________________。
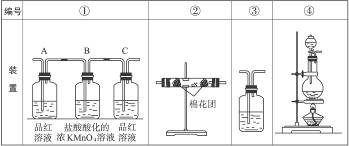
图4-10
思路解析:木炭与浓硫酸加热反应,生成CO2和SO2。CO2和SO2都跟Ca(OH)2反应,生成CaSO3和CaCO3,使澄清石灰水变浑浊,使反应产物无法验证。在SO2、CO2混合气体中,首先用品红溶液可检查SO2存在,然后将SO2氧化除去,再用澄清石灰水检验CO2的存在。
答案:(1)C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O↑
2SO2↑+CO2↑+2H2O↑
(2)④ ② ① ③
(3)验证产物气流中是否有SO2 将SO2全部氧化吸收 确证产物中SO2已被B瓶溶液全部氧化
(4)无水CuSO4(或变色硅胶) 水蒸气 由于产物气流通过①③时会带出水蒸气,所以②必须在①③之前
(5)澄清石灰水 CO2
12.将还原性铁粉分别放入冷的浓H2SO4、浓HNO3中,开始都有大量气泡生成,后来反应不再发生。已知生成的气体有刺激性气味,H2SO4中气体无色,HNO3中气体红棕色;剩余的固体经检验产生了磁性。试完成下列问题:
(1)Fe的氧化产物是__________________。(写化学式,下同)
(2)浓H2SO4的还原产物是______________,浓HNO3的还原产物是__________________。
思路解析:(1)铁被氧化可能得到FeO、Fe2O3、Fe3O4等,有磁性的只有Fe3O4。
(2)浓H2SO4被还原的产物是无色、有刺激性气味的气体,应为SO2;浓HNO3被还原的产物呈红棕色,为NO2。
答案:(1)Fe3O4 (2)SO2 NO2
11.往浅绿色的Fe(NO3)2溶液中,逐滴加入稀盐酸时,溶液的颜色变化应该是( )
A.颜色变浅 B.逐渐变红色 C.没有改变 D.变棕黄色
思路解析:Fe2+和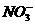 在溶液中可以大量共存,但加入盐酸后,
在溶液中可以大量共存,但加入盐酸后,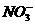 在酸性条件下表现出强氧化性,把Fe2+氧化成Fe3+,这样溶液由浅绿色变成棕黄色。
在酸性条件下表现出强氧化性,把Fe2+氧化成Fe3+,这样溶液由浅绿色变成棕黄色。
答案:D
10.(2004江苏高考,4)下列关于浓硫酸的叙述正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖碳化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
思路解析:根据浓硫酸的脱水性、吸水性、氧化性逐一对照选项,同时考虑其余一些物质反应的特殊性。
答案:C
9.(2010全国高考理综Ⅲ,11)已知KH和H2O反应生成H2和KOH,反应中1 mol KH( )
A.失去1 mol e- B.得到1 mol e- C.失去2 mol e- D.没有电子得失
思路解析:根据KH中的H是负一价的阴离子,所以反应中1 mol KH失去1 mol e-。
答案:A
8.下列各组气体,在通常情况下既能用浓硫酸又能用碱石灰干燥的有( )
A.SO2、O2、N2 B.HCl、Cl2、CO2
C.CH4、H2、CO D.SO2、Cl2、O2
思路解析:被干燥气体既不能与干燥剂反应,也不能被干燥剂吸收,既能用浓硫酸又能用碱石灰干燥的气体有O2、N2、CH4、H2、CO。
答案:C
我综合 我发展
7.将90%H2SO4溶液和10%H2SO4溶液等体积混合,所得溶液的质量分数为( )
A.小于50% B.大于50% C.等于50% D.不能确定
思路解析:等体积的浓硫酸比稀硫酸的密度大,即质量也大,则其所占质量份额也多些,所以最终混合溶液的质量分数更靠近浓硫酸,即大于50%。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com