
题目列表(包括答案和解析)
11.(2010江苏高考,7)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2====2FeCl3+4FeI3 B.3Cl2+2FeI2====2FeCl3+2I2
C.Co2O3+6HCl====2CoCl2+Cl2↑+3H2O D.2Fe3++2I-====2Fe2++I2
思路解析:因为氧化性Cl2>I2,FeCl3>I2所以,FeI3不会生成,A项错误。B、D项正确。因为氧化性Co2O3>Cl2,C项正确。
答案:A
我创新 我超越
10.下列叙述正确的是( )
A.含氧酸能起氧化作用,无氧酸则不能
B.阳离子只有氧化性,阴离子只有还原性
C.失电子难的原子获得电子的能力一定强
D.化学反应中,某元素由化合态变成游离态,此元素可能被氧化,也可能被还原
思路解析:本题可以用枚举法来解。逐项分析:对于选项A,无氧酸也能起氧化作用,如:Zn+2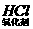 ====ZnCl2+H2↑。对于选项B,处于中间价态的阳(或阴)离子都既有氧化性,也有还原性,如
====ZnCl2+H2↑。对于选项B,处于中间价态的阳(或阴)离子都既有氧化性,也有还原性,如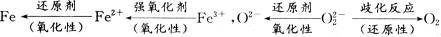 。对于选项C,如稀有气体原子是失电子难的原子,但得电子能力并不强。对于选项D,如电解水生成H2和O2,H元素由化合态变为游离态,被还原;O元素由化合态变为游离态,被氧化。
。对于选项C,如稀有气体原子是失电子难的原子,但得电子能力并不强。对于选项D,如电解水生成H2和O2,H元素由化合态变为游离态,被还原;O元素由化合态变为游离态,被氧化。
答案:D
9.下列叙述正确的是( )
A.含金属元素的离子不一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原,不一定得到金属单质
思路解析:含金属元素的离子不一定是金属阳离子,如高锰酸根离子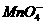 ,故A正确;非金属单质在氧化还原反应中既可以作氧化剂,又可以作还原剂,如在Fe+S====FeS中S作氧化剂,但在S+O2====SO2中S作还原剂,故B错误;某元素从化合态变为游离态时,该元素不一定被还原,关键是看变化时元素的化合价是升高了还是降低了,如KClO3
,故A正确;非金属单质在氧化还原反应中既可以作氧化剂,又可以作还原剂,如在Fe+S====FeS中S作氧化剂,但在S+O2====SO2中S作还原剂,故B错误;某元素从化合态变为游离态时,该元素不一定被还原,关键是看变化时元素的化合价是升高了还是降低了,如KClO3 O2变化中,氧元素被氧化,CuSO4
O2变化中,氧元素被氧化,CuSO4 Cu变化中,铜元素被还原,故正确的说法是:从化合态变为游离态,该元素可能被氧化,也可能被还原,因此C错误;金属阳离子被还原不一定得到金属单质,特别是变价金属,如Fe处在最高价Fe3+时,可能被还原成Fe2+,所以D正确。
Cu变化中,铜元素被还原,故正确的说法是:从化合态变为游离态,该元素可能被氧化,也可能被还原,因此C错误;金属阳离子被还原不一定得到金属单质,特别是变价金属,如Fe处在最高价Fe3+时,可能被还原成Fe2+,所以D正确。
答案:AD
8.指出下列反应中的氧化剂和还原剂,写出发生氧化反应和还原反应的元素名称,并标出发生氧化还原反应的元素化合价及电子转移的方向和数目。
(1)2Fe+3Cl2 2FeCl3
2FeCl3
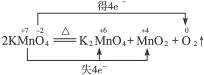
(2)2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)Mg+Cu2+====Mg2++Cu
(4)2KNO3+3C+S K2S+3CO2↑+N2↑
K2S+3CO2↑+N2↑
思路解析:(1)2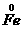 +3
+3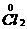
 2
2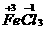 中Fe元素化合价升高,被氧化,所以Fe是还原剂;Cl元素化合价降低,被还原,所以Cl2是氧化剂。铁元素化合价升高,发生氧化反应;氯元素化合价降低,发生还原反应。
中Fe元素化合价升高,被氧化,所以Fe是还原剂;Cl元素化合价降低,被还原,所以Cl2是氧化剂。铁元素化合价升高,发生氧化反应;氯元素化合价降低,发生还原反应。
(2)2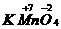

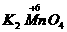 +
+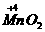 +
+ ↑中O元素化合价升高,被氧化,Mn元素化合价降低,被还原,所以KMnO4既是氧化剂,又是还原剂。Mn元素化合价降低,发生还原反应;O元素化合价升高,发生氧化反应。
↑中O元素化合价升高,被氧化,Mn元素化合价降低,被还原,所以KMnO4既是氧化剂,又是还原剂。Mn元素化合价降低,发生还原反应;O元素化合价升高,发生氧化反应。
(3)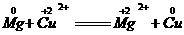 中Mg化合价升高,被氧化,所以Mg是还原剂;Cu化合价降低,被还原,所以Cu是氧化剂。Mg元素化合价升高,发生氧化反应;Cu元素化合价降低,发生还原反应。
中Mg化合价升高,被氧化,所以Mg是还原剂;Cu化合价降低,被还原,所以Cu是氧化剂。Mg元素化合价升高,发生氧化反应;Cu元素化合价降低,发生还原反应。
(4)2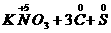

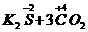 ↑+
↑+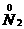 ↑中C元素化合价升高,被氧化,所以C是还原剂;N元素和S元素化合价降低,被还原,所以KNO3和S是氧化剂。C元素化合价升高,发生氧化反应;N元素和S元素化合价降低,发生还原反应。
↑中C元素化合价升高,被氧化,所以C是还原剂;N元素和S元素化合价降低,被还原,所以KNO3和S是氧化剂。C元素化合价升高,发生氧化反应;N元素和S元素化合价降低,发生还原反应。
答案: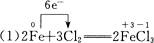
Cl2、Fe,铁、氯
(2)
KMnO4、KMnO4,氧、锰
(3)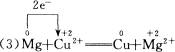
Cu2+、Mg,镁、铜
(4)
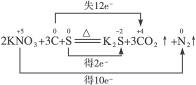
KNO3、S、C,碳、氮、硫
7.下列反应中:①2KClO3 2KCl+3O2↑
2KCl+3O2↑
②C+CO2 2CO
2CO
③HgS+O2 Hg+SO2
Hg+SO2
④2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
⑤2KNO3 2KNO2+O2↑
2KNO2+O2↑
⑥Cl2+H2O====HClO+HCl
(1)属于一种元素还原两种元素的是_____________________________________。
(2)属于同种元素间氧化还原的是_______________________________________。
思路解析:由给定各反应中元素价态的变化找出氧化还原关系。反应①是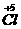 与
与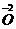 间的氧化还原反应。②是
间的氧化还原反应。②是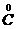 与
与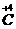 间的氧化还原反应,属于同种元素间的氧化还原反应,这是(2)中的一个答案。反应③是三种元素之间的氧化还原,其中
间的氧化还原反应,属于同种元素间的氧化还原反应,这是(2)中的一个答案。反应③是三种元素之间的氧化还原,其中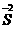 失电子把
失电子把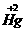 还原为
还原为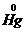 ,将
,将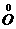 还原为
还原为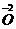 ,恰为(1)的答案。反应④是KMnO4中的
,恰为(1)的答案。反应④是KMnO4中的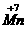 →
→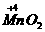 和
和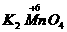 ,属于
,属于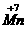 的还原反应,同时部分氧原子由-2价变为0价,发生氧化反应。反应⑤是KNO3中的
的还原反应,同时部分氧原子由-2价变为0价,发生氧化反应。反应⑤是KNO3中的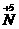 把
把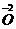 氧化成O2的反应。反应⑥是氯气分子里面1个氯原子失去一个电子转化为HClO中的
氧化成O2的反应。反应⑥是氯气分子里面1个氯原子失去一个电子转化为HClO中的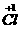 ,另1个氯原子得到此电子转化成HCl中的
,另1个氯原子得到此电子转化成HCl中的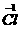 ,是同种元素间的氧化还原反应,是(2)的另一个答案。
,是同种元素间的氧化还原反应,是(2)的另一个答案。
答案:(1)③ (2)②⑥
6.下列反应中,CO2作氧化剂的是( )
A.Ca(OH)2+CO2====CaCO3↓+H2O
B.CO2+C 2CO
2CO
C.2Fe2O3+3C 4Fe+3CO2↑
D.C+H2O
4Fe+3CO2↑
D.C+H2O H2+CO
H2+CO
思路解析:CO2作氧化剂的反应是指其中的某种元素化合价降低的反应。B项中二氧化碳中的碳元素从+4价降到+2价,所以二氧化碳为氧化剂。
答案:B
我综合 我发展
5.下列反应中,氯元素被氧化的是( )
A.2KClO3 2KCl+3O2↑
B.2P+5Cl2====2PCl5
2KCl+3O2↑
B.2P+5Cl2====2PCl5
C.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑ D.H2+Cl2====2HCl
MnCl2+2H2O+Cl2↑ D.H2+Cl2====2HCl
思路解析:氯元素被氧化的反应就是反应中的氯元素的化合价升高的反应。C项中氯元素的化合价从-1升高到0。
答案:C
4.下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化
B.还原剂是一种能够得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的
思路解析:这是一组概念的考查,氧化还原反应的本质是元素原子间的电子得失或偏离;还原剂是在化学反应中失去了电子的物质;物质所含元素化合价升高的反应叫氧化反应。
答案:D
3.氧化还原反应的实质是( )
A.元素化合价发生变化 B.反应中有氧原子的得失
C.反应中有电子得失或电子的偏离 D.反应后生成新物质
思路解析:氧化还原反应的实质是元素的原子间有电子的得失或偏离。
答案:C
2.下列不属于氧化还原反应的是( )
A.3Cl2+6KOH====5KCl+KClO3+3H2O
B.2NO2+2NaOH====NaNO3+NaNO2+H2O
C.SnCl4+2H2O====SnO2+4HCl
D.3CCl4+K2Cr2====2CrO2Cl2+3COCl2+2KCl
思路解析:分析一个化学反应是不是氧化还原反应,最常用的方法就是分析参加反应的元素中是否有化合价的变化。
答案:CD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com