
题目列表(包括答案和解析)
4.100 mL 2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6 mol·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
解析:A项中加入6 mol·L-1盐酸,虽然加快了反应速率,但是使产生的H2量增多。C、D项使盐酸浓度减小,速率减慢。B项中加CuCl2溶液,锌置换出铜,形成原电池,加快了反应速率,也不影响H2量。
答案:B
3.氯化银在溶液中有极微量的电离:AgCl====Ag++Cl-。下列不能说明该电离达到平衡状态的是( )
A.Ag+的浓度不再改变
B.Ag+的生成速率和Ag+、Cl-结合生成AgCl的速率相等
C.AgCl的质量不再减少
D.Ag+与Cl-的物质的量比为1∶1
解析:当一个可逆反应进行到正向反应速率和逆向反应速率相等时,反应物和生成物的浓度不再改变,就达到了“平衡状态”,故A、B、C项可说明。整个过程中,v(Ag+)=v(Cl-),不能说明。故答案选D项。
答案:D
2.在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)====2NO2(g),若N2O4的浓度由0.1 mol·L-1降到0.07 mol·L-1需要15 s,那么N2O4的浓度由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间( )
A.等于5 s B.等于10 s C.大于10 s D.小于10 s
解析:(0.1-0.01)∶15=(0.07-0.05)∶t,t=10 s,因为浓度减小,反应速率变慢,所需时间大于10 s。
答案:C
1.一定量的盐酸与过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaOH(s) B.H2O C.NaCl(s) D.CH3COONa
解析:本题主要考查浓度对化学反应速率的影响。铁跟盐酸反应的实质是:Fe+2H+====Fe2++H2↑,由此可知,要减缓反应速率,且不影响生成氢气的总量,就必须满足“既减小H+浓度,又不影响H+的物质的量”这个条件。
A项中NaOH与盐酸反应,H+的物质的量减小,不正确。
B项中加水,“既可减小H+浓度,又不影响H+的物质的量”,符合题意。
C项中加入NaCl固体,并没有减小H+的浓度,不符合题意。
D项中加入CH3COONa固体,能与盐酸反应生成CH3COOH这一弱电解质,使H+的浓度减小,在反应生成H2的同时又能释放出H+,故生成H2的总量不变,符合题意。
答案:BD
5.把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图所示。其中t1-t2速率变化的主要原因是________________________________________;t2-t3速率变化的主要原因是________________________________________。
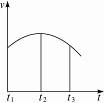
解析:Mg与HCl溶液的反应是放热反应,该反应中并存两个影响化学反应速率的外因:一是反应放出的热能使反应体系温度升高,化学反应速率增大;二是反应使HCl物质的量浓度减小,化学反应速率减小。由图像可知,在t1-t2的时间内温度变化是影响化学反应速率的主要外因,在t2-t3的时间内,HCl物质的量浓度的变化是影响化学反应速率的主要外因。
答案:反应是放热反应,温度升高使化学反应速率提高 HCl物质的量浓度变小使化学反应速率降低
10分钟训练(强化类训练,可用于课中)
4.下列反应能够瞬间完成的是( )
A.硝酸与铜反应 B.HNO3(aq)与NaOH(aq)的反应
C.光照H2与O2的混合物 D.铜绿的生成
解析:溶液中发生的离子反应,能够瞬间完成。HNO3与Cu的反应虽然剧烈,但接触不完全,也不能瞬间完成。光照H2与O2的混合物不反应,铜绿的生成是缓慢锈蚀的结果。
答案:B
3.下列化学反应需要加快化学反应速率的是( )
A.钢铁的腐蚀 B.食物腐烂
C.工业炼钢 D.塑料老化
解析:钢铁的腐蚀、食物腐烂、塑料老化,都需要减慢化学反应速率,否则就会造成材料的损耗与浪费。工业炼钢则需要加快化学反应速率。
答案:C
2.已知反应A+3B====2C+D在某段时间以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5 mol·L-1·min-1 B.1 mol·L-1·min-1
C.2 mol·L-1·min-1 D.3 mol·L-1·min-1
解析:根据A的变化量,求出其他物质的变化量,然后根据定义进行求解。
答案:C
1.下列说法正确的是( )
A.化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率
B.在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值
C.在同一化学反应中,其化学反应速率可以用反应物浓度的改变来表示,也可以用生成物浓度的改变来表示,其值可能相同,也可能不相同
D.化学反应速率的单位可以是g/L·s,也可以是kg/L·s。甚至可以用t/L·s等来表示
解析:本题考查学生对化学反应速率概念的认识。由其概念“单位时间内反应物浓度的减小或生成物浓度的增加”,可以看出它适合于所有的化学反应,并非专指可逆反应,故A项不正确;单位时间是正值,反应物浓度的减小或生成物浓度的增加也是正值,故其比值也必为正值,B项不正确;由化学反应速度的计算公式vB=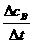 可以看出,其单位中不可能出现g、kg、t等质量单位,D项不正确。
可以看出,其单位中不可能出现g、kg、t等质量单位,D项不正确。
答案:C
12.2010年的新春伊始,北京一号地铁的车厢中都换上了“金施尔康”的广告,宣称它含有抗氧化成分,因此具有防止人体衰老的功能。人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C与“金施尔康”共同具有的性质是什么?结合所给材料分析。
思路解析:亚硝酸盐对人体的毒害是将人体血液中的亚铁离子氧化为铁离子,维生素可缓解其中毒作用,说明维生素具有还原性;“金施尔康”的抗氧化作用实质上也是因为它具有一定的还原性。
答案:还原性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com