
题目列表(包括答案和解析)
3.下列分子含有的电子数目与HF相同,且只有两个极性共价键的是( )
A.CO2 B.NH3 C.H2O D.CH4
解析:HF分子含有10个电子,CO2分子含有22个电子,NH3、H2O、CH4分子中虽然都含有10个电子,但只有水分子含有两个极性共价键。
答案:C
2.下列电子式书写正确的是( )
A.Cl B.
B.
C. 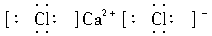 D.
D. 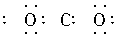
解析:A项中Cl原子漏写了未参与成键的最外层电子;D项中共用电子对应由C、O原子双方提供,而不应由C原子单方提供,且C原子未达到8电子稳定结构,正确的写法为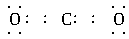 。
。
答案:BC
1.据报道,意大利科学家用普通氧分子与带正电的氧离子作用,制造出新物质O4。下列关于化学键的叙述正确的是( )
A.化学键是原子间的相互作用
B.化学键是两个或多个原子间的相互作用
C.化学键既存在于原子间,又存在于分子间
D.化学键是使离子间或原子间相结合的作用力
解析:由化学键的概念可知,D项正确。成键微粒可以是原子,也可以是离子;化学键不存在于分子间。
答案:D
15.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源之一。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂钯合金作催化剂)。它的特点是使CO与NO反应,生成可参加大气生态环境循环的无毒气体,并促使烃类充分燃烧及促进SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式:___________________________________。
(2)“催化转换器”的缺点是在一定程度上能提高空气的酸度,其原因是:________________。
(3)控制城市空气污染源的方法可以有______________ (多选扣分)。
A.开发氢能源 B.使用电动车
C.植树造林 D.戴上呼吸面具
解析:在催化剂作用下把CO和NO都转化为参与大气生态环境循环的无毒气体,即NO转化为N2,CO转化为CO2,反应方程式为2NO+2CO 2CO2+N2。同时SO2也在催化剂的条件下转化为SO3,从而提高了空气的酸度。控制城市空气的污染源主要是减少煤和汽油的使用。
2CO2+N2。同时SO2也在催化剂的条件下转化为SO3,从而提高了空气的酸度。控制城市空气的污染源主要是减少煤和汽油的使用。
答案:(1)2CO+2NO 2CO2+N2
2CO2+N2
(2)SO2转化为SO3,产生硫酸酸雾
(3)A、B
14.我国已开发出新型煤粉燃烧器,煤的燃烧效率可达95%以上。
(1)当今世界各国能源研究的中心议题之一,就是提高燃烧效率,_____________________。
(2)提高煤的燃烧效率通常需要考虑:①_____________________________________________;②__________________________________________。
解析:提高燃料的燃烧效率,实质上是从多方面控制燃烧反应的条件(包括环境)。它的意义在于节约能源,减少污染。
提高燃料的燃烧效率的措施归纳为两个方面:(1)尽可能使燃料充分燃烧,提高能量转化率;(2)尽可能充分地利用燃料燃烧所释放出的热能,提高热能的利用率。
答案:(1)节约能源,减少污染
(2)①要有适当过量的空气 ②燃料与空气要有足够大的接触面
13.某学生进行右图所示的锌铜原电池的实验:
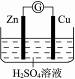
(1)从理论上讲,预期看到的现象是__________________________________________。
(2)实验过程中,观察到锌极上有少量气泡逸出,铜极上有大量气泡逸出。试解释:
________________________________________________________________________。
解析:锌铜原电池:锌比铜活泼,锌片作负极,Zn-2e-====Zn2+;铜棒作正极,H+在正极得电子,2H++2e-====H2↑。Zn片不纯,Zn与杂质构成原电池,在杂质(正极)上,产生H2。
答案:(1)Zn片溶解,Cu片上有大量气泡,电流计指针发生偏转
(2)Zn片不纯,Zn与杂质构成许多微小的原电池所致
12.用纯净的碳酸钙跟稀盐酸反应制取二氧化碳气体,请完成下列问题:
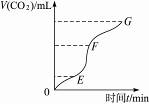
(1)实验过程如图所示,分析判断:______________段化学反应速率最快,______________段收集的二氧化碳最多。
(2)为了减缓上述反应的化学反应速率,欲向溶液中加入下列物质,你认为可行的是______。
A.蒸馏水 B.NaCl固体
C.NaCl溶液 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(任答两种)
解析:根据图象,可知EF段斜率最大,说明产生CO2的速率最快,即化学反应速率最快。由纵轴V(CO2)可知EF段最长,即该段收集的CO2最多。影响化学反应速率的因素很多,如温度、固体的表面积、反应物的状态、溶液的浓度、催化剂等。向溶液中加入蒸馏水、NaCl溶液可减小盐酸的浓度;加入浓盐酸增大了盐酸的浓度;加入NaCl固体对浓度无影响。故A、C项可减小反应速率。除此之外,降低温度,用块状更大的碳酸钙(减小接触面积)等可减小化学反应速率。
答案:(1)EF EF (2)AC
(3)降温 用块状更大的碳酸钙
11.合成氨反应:3H2+N2 2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)(用mol·L-1·s-1表示),则正确的关系是( )
2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)(用mol·L-1·s-1表示),则正确的关系是( )
A.v(H2)=v(N2)=v(NH3) B.v(N2)=2v(NH3)
C.v(H2)=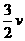 (NH3)
D.v(N2)=3v(H2)
(NH3)
D.v(N2)=3v(H2)
解析:根据化学反应中,用各物质所表示的速率之比等于它们在化学反应方程式中的化学计量数之比,可有如下关系:
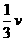 (H2)=v(N2)=
(H2)=v(N2)=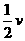 (NH3)(或v(H2)∶v(N2)∶v(NH3)=3∶1∶2)
(NH3)(或v(H2)∶v(N2)∶v(NH3)=3∶1∶2)
由此可推得以下关系式:
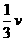 (H2)=v(N2),v(N2)=
(H2)=v(N2),v(N2)=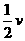 (NH3),
(NH3),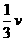 (H2)=
(H2)=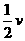 (NH3)。即正确的选项为C。
(NH3)。即正确的选项为C。
答案:C
10.锂电池是新型高能电池,它以质轻、容量大而受到重视,目前已经制成多种功能的锂电池。某种锂电池的总反应可表示为:Li+MnO2====LiMnO2。若该电池提供0.5 C电荷量,则消耗正极材料的质量约为(其他损耗忽略不计)( )
A.3.5 g B.7 g C.4.52×10-4 g D.43.5 g
解析:MnO2为正极材料,
MnO2-e-,n(MnO2)=n(e-)=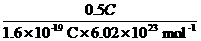 =5.2×10-6
mol,m(MnO2)=5.2×10-6 mol×87
g·mol-1=4.52×10-4 g。
=5.2×10-6
mol,m(MnO2)=5.2×10-6 mol×87
g·mol-1=4.52×10-4 g。
答案:C
9.工业上用氮气和氢气合成氨:N2+3H2 2NH3(反应放热),从反应速率和化学平衡两方面看,合成氨的适宜条件一般为压强:20 MPa-50 MPa,温度:500 ℃左右,催化剂:铁触媒。
2NH3(反应放热),从反应速率和化学平衡两方面看,合成氨的适宜条件一般为压强:20 MPa-50 MPa,温度:500 ℃左右,催化剂:铁触媒。
下列有关合成氨工业的叙述不正确的是( )
A.使用铁触媒,可使氮气和氢气混合气体之间的反应在较低温度下取得较高的反应速率
B.工业上选择上述条件下合成氨,可以使氮气全部转化为氨
C.上述化学平衡的移动受到温度、反应物的浓度、压强等因素的影响
D.温度升高,不利于提高反应速率
解析:使用铁触媒能等幅度地加快正、逆反应速率,虽然平衡不发生移动,但能缩短达到合成氨平衡的时间。但对于可逆反应,无论什么条件下,都不可能进行到底。通过改变影响化学平衡移动的条件(如温度、反应物的浓度、压强等因素),可以改变化学反应进行的限度。温度升高,有利于提高反应速率。
答案:B、D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com