
题目列表(包括答案和解析)
11.下列电子式正确的是( )
A. 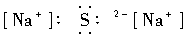 B.
B.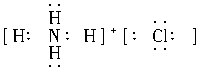
C. 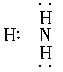 D.
D.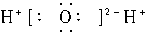
解析:
A项Na2S的电子式应为Na+[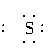 ]2-Na+;C.NH3的电子式应为:
]2-Na+;C.NH3的电子式应为: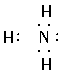 ;D项H2O的电子式应为
;D项H2O的电子式应为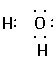 。
。
答案:B
10.下列表示物质形成过程的电子式正确的是( )
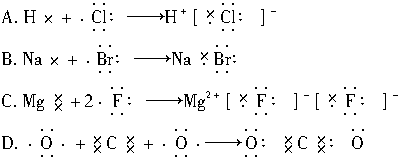
解析:HCl为共价化合物,电子式为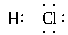 ;NaBr为离子化合物,电子式应为Na+
;NaBr为离子化合物,电子式应为Na+ 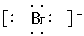 ;MgF2的电子式为
;MgF2的电子式为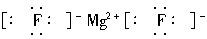 ,所以A、B、C项表示错误。
,所以A、B、C项表示错误。
答案:D
9.下列判断不正确的是( )
A.SO2具有可燃性 B.HCl是共价化合物
C.纯碱是碳酸盐 D.H2SO4是离子化合物
解析:SO2不具有可燃性,H2SO4不是离子化合物。故A、D项不正确。
答案:AD
8.下列过程中,共价键被破坏的是( )
A.晶体碘升华 B.溴蒸气被木炭吸附
C.食盐受热熔化 D. HCl气体溶于水
解析:HCl溶于水,在水分子作用下,电离为H+和Cl-,原HCl分子中共价键破坏。食盐熔化时,电离为Na+和Cl-,原NaCl中的离子键破坏,其他过程只破坏分子间的作用力即可。
答案:D
7.下列说法中正确的是( )
A.难失电子的原子,获得电子的能力一定强
B.易得电子的原子所形成的简单阴离子,其还原性一定强
C.在离子化合物中不可能存在非极性键
D.离子化合物在熔融状态下都能导电
解析:稀有气体元素原子既难失电子也难得电子,故A项不正确;F原子得电子的能力较强,但F-却很难失去电子,其还原性较差,B项不正确;Na2O2是离子化合物,其中的O-O为非极性键。Na2O2是离子化合物,但是含有非极性键,C项错误。
答案:D
6.下列事实中,能够证明HCl是共价化合物的是( )
A.HCl易溶于水 B.液态的HCl不导电
C. HCl不易分解 D. HCl溶于水能电离,呈酸性
解析:液态HCl不发生电离,故HCl为共价化合物。
答案:B
5.下列物质中既含有离子键又含有共价键的是( )
A.HCl B.NH4Cl C.NaOH D.MgBr2
解析:NH4Cl是由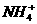 和Cl-通过离子键构成的,
和Cl-通过离子键构成的,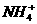 中的N-H键是极性共价键;NaOH是由Na+和OH-通过离子键构成的,OH-中的O-H键是极性共价键。MgBr2中只有离子键,HCl中只有共价键。
中的N-H键是极性共价键;NaOH是由Na+和OH-通过离子键构成的,OH-中的O-H键是极性共价键。MgBr2中只有离子键,HCl中只有共价键。
答案:BC
4.下列元素的原子在形成不同物质时,既能形成离子键,又能形成极性键和非极性键的是( )
A.K B.Ca C.I D.Ne
解析:活泼金属元素的原子成键时,一般只形成离子键,所以K、Ca形成化合物时只能形成离子化合物;稀有气体元素Ne是单原子分子,不可能形成非极性键或极性键,能满足题目要求的只有I,如NaI、HI、I2。
答案:C
3.只有化合物中才能存在的化学键是( )
A.离子键 B.共价键 C.非极性键 D.极性键
解析:离子键和极性键一定存在于化合物中;共价键和非极性键可能存在于化合物中(如Na2O2、H2O2等),也可能存在于单质中(如O2、N2等)。
答案:AD
2.下列分子中,所有原子都满足最外层为8电子结构的是( )
A.H2O B.BF3 C.CCl4 D.PCl5
解析:H2O分子中每个氢原子都与氧原子形成一个共价键,此时氧原子最外层为8电子结构,但氢原子外层只有2个电子,故A项错;BF3分子中3个F原子与B原子最外层的3个电子形成3个共价键,B原子最外层有6个电子,B项不正确;碳原子最外层有4个电子,与4个氯原子形成4个共价键,此时碳、氯原子均达8电子结构,C项正确;PCl5中磷原子最外层有5个电子,若与5个氯原子形成共价键时,磷原子最外层有10个电子,D项不正确。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com