
题目列表(包括答案和解析)
5.一种新型燃料电池,是用两根金属铂作电极插入KOH溶液中,然后向两极上分别通入H2和O2,下列说法不正确的是( )
A.通入H2的电极为负极
B.通入O2的一极电极反应为2H2O+O2+4e-====4OH-
C.随着放电的进行,负极附近pH上升
D.标准状况下通入5.6 L O2完全反应后有1 mol电子转移
解析:电极反应为:
正极:2H2O+O2+4e-====4OH-
负极:2H2+4OH--4e-====4H2O
所以通H2的一极为负极,并且负极pH下降。
答案:C
4.将金属A和金属B分别放入稀H2SO4中有氢气生成。若将金属A和金属B相连后投入稀H2SO4中发现A被腐蚀,B未被腐蚀,关于A、B的叙述正确的是( )
A.金属活动性A>B
B.还原性B>A
C.在后者装置中金属A发生还原反应,金属B发生氧化反应
D.金属B的表面有明显气泡产生,金属A表面无明显现象
解析:金属A和金属B相连投入稀H2SO4中,形成原电池,A被腐蚀说明A失去电子,被氧化,作负极,则A比B的金属活动性强,还原性A强于B。故A项正确,B、C项错误。原电池中,H+在正极B上得到电子,生成H2,B的表面有明显气泡产生,A的表面无明显现象,故D项正确。
答案:AD
3.随着人们生活质量的提高,废电池必须进行集中处理的问题被提上议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉、铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中的石墨电极
解析:电池中的重金属离子会对土壤和水源产生污染,故必须要集中回收处理。
答案:B
2.已知空气锌电池的电极反应为:
锌片:Zn+2OH--2e-====ZnO+H2O
石墨: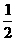 O2+H2O+2e-====2OH-
O2+H2O+2e-====2OH-
据此判断,锌片是( )
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
解析:锌失去电子,被氧化,作原电池的负极。
答案:A
1.一个原电池的总反应的离子方程式是Zn+Cu2+====Zn2++Cu,该反应的原电池的正确组成是( )
|
|
A |
B |
C |
D |
|
正极 |
Zn |
Cu |
Cu |
Fe |
|
负极 |
Cu |
Zn |
Zn |
Zn |
|
电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
CuCl2 |
解析:由离子方程式:Zn+Cu2+====Zn2++Cu可知原电池中,Zn应作负极,Cu或Fe可作正极,A项错误。电解质溶液应为可溶性铜盐溶液,所以B项错误。故C、D项正确。
答案:CD
7.关于用水制取二级能源H2,以下研究方向不正确的是( )
A.构成水的氢和氧是可以燃烧的物质,因此,可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳能聚焦,产生高温,使水分解产生H2
C.寻找高效催化剂,使水分解产生H2,同时释放能量
D.寻找特殊的化学物质,用于开发廉价能源,以分解水制取H2
解析:根据“自然界中以现成形式提供的能源称为一级能源”,可知6题中的水力、天然气属于一级能源;根据“需依靠其他能源间接制取的能源称为二级能源”,可知电能、水煤气属于二级能源。7题中的A项,水是一种物质,但组成它的元素氢、氧不能称为物质,只有将氢转化为单质氢气时才可以燃烧,故A项不正确;使水分解的条件有电解、高温、合适的催化剂等,B项充分利用自然资源(太阳能)以产生高温来分解水,是一种较理想的方案,则B项正确;C项即是寻找合适的催化剂,但并不能改变水的分解反应是吸热反应这一事实,即不可能释放能量,则C项不正确;若用电解法制取氢气,因消耗大量的电能而成本太高,D项是开发廉价能源,以分解水制取H2,也是可行的方案,则D项正确。
答案:6.AC 7.AC
30分钟训练(巩固类训练,可用于课后)
6.下列叙述正确的是( )
A.电能是二级能源 B.水力是二级能源
C.天然气是一级能源 D.水煤气是一级能源
5.下列反应属于放热反应的是( )
A.铝和盐酸反应 B.碳和CO2加热
C.石灰石的分解 D.天然气燃烧
解析:B、C项为吸热反应。
答案:AD
能源可划分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源间接制取的能源称为二级能源。H2是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O(l) 2H2↑(g)+O2↑(g)。根据以上叙述,完成6-7题。
2H2↑(g)+O2↑(g)。根据以上叙述,完成6-7题。
4.废电池污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是( )
A.锌、铁、铜 B.汞、镉、铅 C.石墨 D.二氧化锰
解析:电池中的汞、镉、铅等重金属离子对土壤和水源造成污染。故选B项。
答案:B
3.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%-40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-====2H2O和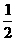 O2+H2O+2e-====2OH-则下列叙述正确的是( )
O2+H2O+2e-====2OH-则下列叙述正确的是( )
A.通H2的一极是正极,通入O2的一极是负极
B.通O2的一极是正极,通入H2的一极是负极
C.工作一段时间后电解质溶液pH增大
D.工作时负极区附近pH减小
解析:H2失去电子为负极,负极产生水稀释,且消耗OH-,碱性减弱,pH减小。O2得到电子为正极。故A、C项错误,B、D项正确。
答案:BD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com