
题目列表(包括答案和解析)
6.下列反应既属于氧化还原反应,又是吸热反应的是( )
A.铝片与稀盐酸的反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与CO2的反应 D.甲烷在氧气中的燃烧反应
解析:A选项是放热反应,发生的是氧化还原反应。B选项是吸热反应,不发生氧化还原反应。D选项是放热反应,发生的是氧化还原反应。
答案:C
5.下列不是化石能源的是( )
A.氢气 B.煤 C.石油 D.天然气
解析:化石能源是煤、石油和天然气。故选A。
答案:A
4.下列说法不正确的是( )
A.任何化学反应都伴有能量变化
B.化学反应中的能量变化都表现为热量的变化
C.反应物的总能量高于生成物的总能量时,发生放热反应
D.反应物的总能量低于生成物的总能量时,发生吸热反应
解析:化学反应中的能量变化通常表现为热量的变化,其他还有光能等。
答案:B
3.对于陶瓷烧制过程中的变化描述正确的是( )
A.整个制作过程只有物理变化,没有化学变化
B.整个制作过程既有物理变化,又有化学变化
C.在将陶器放入窑炉之前只发生物理变化,放入窑炉之中点火之后只发生化学变化
D.在将陶器放入窑炉之前可能发生化学变化,但放入窑炉之中点火之后只发生化学变化
解析:整个制作过程既有物理变化,又有化学变化。
答案:B
2.下列关于陶瓷烧制过程中的守恒关系的描述正确的是( )
A.由于整个制作过程中会造成原料(如黏土)的损失,所以质量守恒定律在此不成立
B.整个制作过程中总质量、总能量肯定是守恒的
C.整个烧制过程中质量守恒但是能量不守恒
D.因为是个开放的体系,无法讨论守恒问题
解析:分析问题要注意选好研究的对象,守恒规律的研究对象是整个反应体系,从整个反应体系来看总质量、总能量肯定是守恒的。
答案:B
1.下列关于能量转化方式的叙述错误的是( )
A.太阳能可转化为化学能 B.化学能可转化为热能
C.化学能可转化为电能 D.化学能可直接转化为机械能
解析:化学能是不能直接转化成机械能的。
答案:D
3.城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO、H2的混合气体,它由煤炭与水蒸气在高温下反应制得,故又称水煤气。试完成下列问题:
(1)写出制取水煤气的主要化学方程式______________________________________________,
该反应是________________反应(填“吸热”或“放热”)。
(2)设液化石油气的主要成分为丙烷(C3H8 ),其充分燃烧后产物为CO2和 H2O,试比较完全燃烧等质量的C3H8及CO所需氧气的质量比为____________________。
解析:(1)反应方程式为C+H2O CO+H2为吸热反应。
CO+H2为吸热反应。
(2)C3H8+5O2====3CO2+4H2O
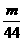 5×
5×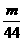 ×32
×32
2CO + O2====2CO2
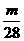
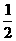 ×
×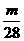 ×32
×32
即完全燃烧等质量的C3H8及CO所需氧气的质量比为5×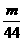 ×32∶
×32∶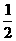 ×
×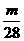 ×32=70∶11
×32=70∶11
答案:C+H2O CO+H2 吸热
(2)70∶11
CO+H2 吸热
(2)70∶11
10分钟训练(强化类训练,可用于课中)
2.下列说法不正确的是( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需要加热即可发生
C.需要加热条件的化学反应都是吸热反应
D.硫酸与足量氢氧化钠发生中和反应生成1 mol水所释放的热量称为中和热
解析:化学反应过程往往伴随着能量的变化,反应是放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小;有的放热反应开始也需要加热;反应开始时需要加热的反应可能是吸热反应,也可能是放热反应。酸碱发生中和反应生成1 mol H2O时所释放的热量称为中和热。
答案:BC
1.下列反应中属于吸热反应的是( )
A.镁与盐酸反应放出氢气 B.氢氧化钠与盐酸的反应
C.硫在空气或氧气中燃烧 D.Ba(OH)2·8H2O与NH4Cl反应
解析:本题主要考查学生对常见放热、吸热反应的了解情况。金属与酸的置换反应、中和反应以及燃烧反应等均为放热反应,只有D项为吸热反应。
答案:D
16.目前常用的镍镉(NiCd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O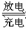 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。
(1)该电池放电时的负极材料是_________________。
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
(2)以下说法正确的是__________________。
①以上反应是可逆反应 ②以上反应不是可逆反应 ③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④ C.①④ D.②③
(3)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重,这是因为___________________
_____________________________________________________________________________。
(4)下图是废弃镍镉电池中的重金属渗入水体后,进入人体的一条途径:
A-B-C-D-人
生物体D中重金属浓度________________(填“大于”“等于”或“小于”)生物体A中重金属浓度,这是通过食物链_______________作用所引起的。除上述途径外,被污染水体中的重金属还可以直接通过_______________ (途径)进入人体。
(5)另一种常用的电池是锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电荷量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成,电池总反应可表示为Li+MnO2====LiMnO2。
试完成下列问题:
锂电池比容量特别大的原因。
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因。
解析:根据原电池原理及生物学知识综合分析解决。
答案:(1)C (2)B
(3)在酸性土壤中,Ni(OH)2、Cd(OH)2和酸反应生成Ni2+和Cd2+
(4)大于 富集 饮水
(5)Li的摩尔质量小 2Li+2H2O====2LiOH+H2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com