
题目列表(包括答案和解析)
8.在海湾战争期间,科威特大批油井爆炸着火。在灭火工作中,下列措施不能考虑用于灭火的是( )
A.设法阻止石油喷射 B.设法降低火焰温度
C.设法降低石油着火点 D.设法使火焰隔绝空气
解析:物质的着火点是固定的,是由物质的本质决定的,不能降低。故选C。
答案:C
7.关于锂的结构和性质的判断,错误的是( )
①与水反应比钠剧烈 ②密度比钠小 ③氧化物暴露于空气中易吸收CO2 ④阳离子最外层电子数和钠的相同 ⑤是还原剂
A.只有① B.③和⑤ C.②和③ D.①和④
解析:碱金属随着核电荷数的递增,金属活泼性增强,故①错。Li+最外层只有2个电子,故④错。
答案:D
6.砹(At)是核电荷数最大的卤族元素,推测砹或砹的化合物最不可能具有的性质是( )
A.砹化氢(HAt)很稳定 B.砹易溶于某些有机溶剂
C.砹是有色固体 D.AgAt不溶于水,NaAt的熔点较高
解析:卤素氢化物的稳定性是随着非金属活泼性增强而递增的,氟的非金属性最强,所以氟化氢最稳定。砹的活泼性较F、Cl、Br、I都差,其氢化物应该不如碘化氢稳定。卤素单质有易溶于某些有机溶剂的特性,砹为卤素,其单质也应易溶于某些有机溶剂。卤素单质氟、氯、溴、碘均有颜色,砹单质也必然有颜色。卤素单质随相对分子质量递增熔沸点递增。氟、氯单质为气态,溴单质为液态,碘单质为固态,砹是比碘相对分子质量还大的卤素,肯定为固态。AgCl、AgBr、AgI均为不溶于水的固体,依次可推知AgAt也不溶于水。NaCl、NaBr、NaI等卤素的碱金属盐都属于离子晶体,NaAt也属于离子晶体,因此有较高的熔沸点。
答案:A
5.关于卤素的下列叙述正确的是( )
A.卤素是典型的非金属元素,因此不能与其他非金属元素化合
B.卤素单质越活泼,其熔沸点就越高
C.卤素各单质都能和水剧烈反应
D.卤素单质都能和H2反应,且气态氢化物的稳定性随单质氧化性的增强而增强
解析:卤素能与其他非金属化合,如H、C、O等。卤素单质越活泼,相对分子质量越小,熔沸点越低。卤素单质中只有氟能与水剧烈反应。
答案:D
4.下列关于碱金属的描述正确的是( )
A.碱金属都可以保存在煤油里
B.硬度小、密度小、熔点低
C.在空气中加热均可生成多种氧化物
D.碱金属与水反应,均漂在水上
解析:A项中,金属锂的密度为0.534 g·cm-3,会浮在煤油的上面,故A项错误。B项中,通常状况下,碱金属都属于软金属,即硬度小。密度最大的铯仅有1.879 g·cm-3,熔点最高的锂仅为180.5 ℃,故碱金属密度小、熔点低,是正确的。C项中,在空气中加热,Li与O2反应只生成Li2O,即C项错误。D项中,铷、铯的密度均大于1 g·cm-3,所以D项也不正确。
答案:B
3.“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外观像冰。1体积“可燃冰”可贮载100-200体积的天然气。下面关于“可燃冰”的叙述不正确的是( )
A.“可燃冰”有可能成为人类未来的重要能源
B.“可燃冰”是一种比较洁净的能源
C.“可燃冰”提供了水可能变成油的例证
D.“可燃冰”的主要可燃成分是甲烷
解析:1体积“可燃冰”可贮载100-200体积的天然气,天然气的主要成分是甲烷。甲烷燃烧生成二氧化碳和水,无污染。油中含C、H等元素,而H2O中只含H、O两种元素,水不可能变成油。
答案:C
2.右图是两个反应反应前后反应物总能量和生成物总能量的比较图,对于A、B两个反应的说法正确的是( )
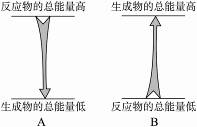
A.A反应是放热反应,B反应也是放热反应
B.A反应是放热反应,B反应是吸热反应
C.A反应是吸热反应,B反应也是吸热反应
D.A反应不需要加热,B反应必须加热
解析:若反应物总能量高于生成物总能量,则反应为放热反应,反之,为吸热反应;但是无论是吸热反应,还是放热反应都与反应加热不加热无关。
答案:B
1.下列说法不正确的是( )
A.放热反应在常温下一定很容易发生
B.反应是吸热还是放热,是由反应物和生成物所具有的总能量相对大小决定的,而与反应条件无关
C.化石燃料在燃烧过程中能产生污染环境的CO和SO2等有害气体
D.化石燃料汽化后燃烧,燃烧效率将降低
解析:无论吸热反应还是放热反应的发生,都需要一定的条件--引发条件,而反应的吸热或放热是反应过程中的能量变化,“引发条件”和“能量变化”不能混为一谈,有许多放热反应在常温下并不能进行,如铁粉和硫粉、氢气和氧气、汽油燃烧等。常温下不能进行的原因是缺乏“引发条件”--反应开始所需最低温度,故选项A错误;B项说法是正确的;化石燃料煤、天然气和石油等含有一定量硫,故不经处理就直接燃烧会产生有害气体CO、SO2等,所以C项说法正确;化石燃料经深加工后变为气体燃料后,不仅能减少SO2、CO等有害气体的生成,还可使其燃烧更加充分而提高燃烧效率,故D项错误。
答案:AD
8.如右图所示,把试管放入盛有25 ℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中。试完成下列问题:
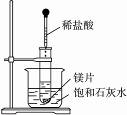
(1)实验中观察到的现象是_______________________________________________________。
(2)产生上述现象的原因是_______________________________________________________。
(3)写出有关反应的离子方程式:_________________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量__________________ (填“大于”“小于”或“等于”)镁片和盐酸的总能量。
解析:盐酸与镁片反应产生H2,同时放出热量。饱和石灰水吸收热量使温度升高,Ca(OH)2的溶解度随温度升高而减小,故有Ca(OH)2固体析出。Mg与盐酸反应放热,则MgCl2与H2的总能量相对于镁片和盐酸的总能量要低。
答案:(1) 镁片上有大量气泡产生、镁片逐渐溶解、烧杯中析出晶体
(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体
(3)Mg+2H+====Mg2++H2↑
(4)小于
30分钟训练(巩固类训练,可用于课后)
7.下列物质加入水中显著放热的是( )
A.固体氢氧化钠 B.生石灰 C.无水乙醇 D.固体硝酸铵
解析:NaOH、CaO溶于水放热,硝酸铵固体溶于水吸热,无水乙醇溶于水热效应不明显。
答案:AB
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com