
题目列表(包括答案和解析)
1.自从1803年英国化学家、物理学家道尔顿提出原子假说以来,人类对原子结构的研究不断深入、不断发展,通过实验事实不断地丰富、完善原子结构理论。请判断下列关于原子结构的说法正确的是( )
A.所有的原子都含有质子、中子和电子三种粒子
B.所有的原子中的质子、中子和电子三种粒子的个数都是相等的
C.原子核对电子的吸引作用实质上是原子核中的质子对核外电子的吸引
D.原子中的质子、中子和电子三种粒子不可再分
解析:本题着重考查人类现在对原子结构的认识水平和将来可能的变化,培养我们学会用发展和辩证的观点看待问题。所有的原子都含质子和电子,并且二者的个数是相等的,因为质子和电子带的电荷相等、电性相反,只有二者的个数相等才能使原子不显电性。需要注意的是,并不是所有原子都含有中子,如11H中就只含一个质子和一个电子而没有中子,多数原子的中子数和质子数比较接近但并没有必然的数量关系。所以,A和B两个选项是错误的。
原子核对核外电子的吸引是一种电性作用,因为中子不显电性,质子和电子带相反电荷,所以C选项是正确的。从发展的观点出发,原子中的质子、中子和电子三种基本构成粒子有可能再进一步分成更小的粒子,如科学家们已经研究发现了质子和中子里面还有更小的粒子--夸克,所以D选项是错误的。
答案:C
5.按要求完成下列空白:
(1)化合价主要决定于______________________________________________;
(2)同位素主要决定于________________________________________________;
(3)质量数决定于______________________________________________;
(4)原子序数决定于______________________________________________;
(5)元素的化学性质主要决定于____________________________________________。
答案:(1)最外层电子数
(2)质子数 中子数
(3)质子数和中子数
(4)质子数
(5)最外层电子数
10分钟训练(强化类训练,可用于课中)
4.在周期表中,所含元素的种类最多的是( )
A.Ⅷ族 B.ⅠA族 C.0族 D.ⅢB族
解析:镧(La)系和锕(Ac)系各有15种元素,它们分别在ⅢB族的第六、第七周期。这样ⅢB族内共有32种元素。
答案:D
3.氟、氯、溴、碘四种元素,它们的下列性质的递变规律不正确的是( )
A.单质密度依次增大
B.单质的熔沸点依次升高
C.Cl2可以从KBr溶液置换出Br2
D.F2可以从NaCl溶液中还原出Cl2
解析:在NaCl溶液中,F2是先与水反应而不是直接与NaCl反应。F2与H2O反应的化学方程式为:2F2+2H2O====O2+4HF。
答案:D
2.下列关于碱金属的电子结构和性质的叙述中不正确的是( )
A.碱金属原子最外层都只有一个电子,在化学反应中容易失去
B.都是强还原剂
C.都能在O2中燃烧生成过氧化物
D.都能与水反应生成碱
解析:4Li+O2 2Li2O。碱金属元素的原子和单质,在结构和性质上,既有相似性又有差异性。
2Li2O。碱金属元素的原子和单质,在结构和性质上,既有相似性又有差异性。
答案:C
1.据报道,月球上有大量 存在,
存在, 可以作为核聚变材料。下列关于
可以作为核聚变材料。下列关于 的叙述正确的是( )
的叙述正确的是( )
A.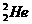 和
和 互为同位素
互为同位素
B. 原子核内中子数为2
原子核内中子数为2
C. 原子核外电子数为2
原子核外电子数为2
D. 代表原子核内有2个质子和3个中子的氦原子
代表原子核内有2个质子和3个中子的氦原子
解析: 和
和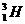 质子数不同,不是同位素;
质子数不同,不是同位素; 的电子数为2,中子数为3-2=1。
的电子数为2,中子数为3-2=1。
答案:C
17.设计实验探讨向AlCl3溶液中加入过量的NaOH和向NaOH溶液中加入过量的AlCl3现象是否一样。
思路解析:向AlCl3溶液中逐滴加入NaOH有白色沉淀生成,当NaOH过量时沉淀溶解,最后生成物为NaAlO2。反应的离子方程式为:Al3++3OH-====Al(OH)3↓,Al(OH)3+OH-====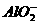 +2H2O
+2H2O
向NaOH溶液中逐滴加入AlCl3溶液时,观察到的现象是:开始有白色沉淀生成,振荡后立即消失,继续滴加AlCl3溶液直至过量时,又出现白色沉淀,且不消失。这是因为反应开始时,由于NaOH溶液过量,滴入的AlCl3和NaOH作用转化为NaAlO2,当加入过量AlCl3时,AlCl3和NaAlO2在溶液里发生反应,生成沉淀Al(OH)3。其反应的离子方程式为:
Al3++3OH-====Al(OH)3↓,Al(OH)3+OH-====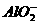 +2H2O,Al3++3
+2H2O,Al3++3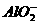 +6H2O====4Al(OH)3↓
+6H2O====4Al(OH)3↓
答案:不一样
16.将甲烷、氧气、过氧化钠放入密闭容器中,在150 ℃条件下用电火花引发反应后,3种物质都恰好完全反应,容器中的压强为零。则原混合物中3种物质的质量之比为___________,反应后容器中的物质是___________。
思路解析:本题考查CO2、H2O(g)与Na2O2的反应。
欲正确解答本题,应注意理解“容器中的压强为零”的含义,对方程式进行适当加和,由加和后的方程式找出答案。
此类题涉及多个相关的反应,某一反应的生成物是另一反应的反应物。一般可以先写出分步反应的化学方程式,然后根据题意分析总反应的反应物和生成物,用类似上面的“加和法”得出总反应式。
容器中发生的各步反应如下:
①CH4+2O2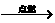 CO2+2H2O ②2Na2O2+2CO2====2Na2CO3+O2③2Na2O2+2H2O====4NaOH+O2↑
CO2+2H2O ②2Na2O2+2CO2====2Na2CO3+O2③2Na2O2+2H2O====4NaOH+O2↑
容器中总反应的反应物是CH4、Na2O2、O2,生成的CO2、H2O、O2可以循环反应,可以看成是中间产物,由于反应后在150 ℃条件下容器中的压强为零,说明最后容器中的物质不含气体和水,最后的生成物只有Na2CO3、NaOH。将①②③分别乘以适当的系数后加和,以消去生成物中的中间产物CO2、H2O和O2。①×2+②+③×2得总反应式:
2CH4+O2+6Na2O2====2Na2CO3+8NaOH
因此,原混合物中CH4、O2、Na2O2三种物质的质量之比为:2×16∶16×2∶6×78=8∶8∶117。
答案:8∶8∶117 Na2CO3、NaOH
我创新 我超越
15.用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入______________________________。
(2)除去蒸馏水中溶解的O2常采用____________________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是___________________________________。
方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
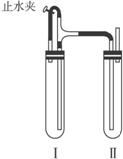
图3-8
(1)在试管Ⅰ里加入的试剂是________________________________________。
(2)在试管Ⅱ里加入的试剂是________________________________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是___________________________________________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是__________________________。
思路解析:方法一中根据FeSO4具有易被氧化和易水解的特点,在配制其溶液时还需加入稀H2SO4和铁屑;蒸馏水中若溶有O2,则会加速Fe(OH)2氧化,因此可采用煮沸法除去O2。为避免生成的Fe(OH)2沉淀接触O2,可用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液方可达到目的。
方法二的原理是利用稀H2SO4和铁屑产生氢气,先赶净装置中空气。确定赶净空气后,再夹紧止水夹,通过H2产生的压强将FeSO4压入NaOH溶液中去,从而使产生的白色Fe(OH)2沉淀在H2的还原性气氛中得以较长时间保持。
答案:方法一:(1)稀H2SO4、铁屑 (2)煮沸 (3)避免生成的Fe(OH)2沉淀接触O2
方法二:(1)稀H2SO4、铁屑 (2)NaOH溶液(3)检验试管Ⅱ出口处排出氢气的纯度。当排出的H2纯净时,再夹紧止水夹 (4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
14.铝可以从铝土矿中获取,铝土矿是不纯净的铝的氧化物(杂质为Fe2O3和SiO2),它是非再生资源。假如我们对铝的消费保持现有速度,我们能获得生产足够的铝所需的铝土矿仅能维持30年左右。由此看来,保护现有自然资源和对非再生资源的再利用,是值得我们考虑的。但是在废物回收过程中,仍有相当大的难度,其关键的因素主要涉及旧金属的收集与其他废物的分离、回收和提炼金属的费用、金属本身的价值等(已知1 mol电子电量荷约为105 C)。
(1)试说明回收铝的过程中存在的困难。
(2)为什么金的回收率比铝的回收率要大得多?
(3)常温下,SiO2同强碱或强酸是很难反应的,现利用盐酸、氢氧化钠溶液、氮气、二氧化碳和水,从铝土矿中提取纯净的Al2O3。试设计一个适用于工业生产上提纯Al2O3的实验方案,用化学方程式表示提纯的过程。
(4)制取1 mol Al理论上需要多少库仑的电荷量?
(5)假定用6 V的直流电源进行电解,制2.7吨铝需要多少千焦的电能?(请列式并计算)
(6)在1.01×105 Pa,27 ℃时,每生产1 mol Al,理论上在阳极生成O2的体积为多少升?(请列式并计算)
(7)如果每度电的费用为0.60元,试计算生产厂家每生产1吨铝需付出的电费为多少元。(1度电=3 600 kJ)(请列式计算)
答案:(1)回收铝的过程中存在的困难是:①人们的环境意识薄弱;②回收和提炼金属的费用较高;③铝同其他废物的分离较困难;④铝本身价值并不高;⑤旧金属的收集缺乏专门的机构。
(2)金比铝价值要高,另一方面,金活动性弱,容易回收。
(3)Fe2O3和SiO2与强碱都不反应,因此可把铝土矿溶于强碱溶液中,过滤除去杂质,即得到偏铝酸钠溶液,往滤液中加酸即可得氢氧化铝沉淀,由于氢氧化铝沉淀可和强酸反应,所以要得到较多的沉淀,最好加弱酸,方程式表示为:
①Al2O3+2NaOH====2NaAlO2+H2O
②NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3
③2Al(OH)3====Al2O3+3H2O
(4)这是一个涉及氧化还原反应的问题。氧化铝要被还原成单质铝,化合价必须从+3降低到0,即要得到1 mol Al必须转移3 mol的电子,所需电荷量为3×105C。
(5)直接代入物理中有关电能的计算公式,可得:2.7×106/27×3×105×6×10-3kJ=1.8×108 kJ。
(6)根据电解方程:2Al2O3====4Al+3O2↑,每产生1 mol Al的同时生成0.75 mol O2,由于此状态是非标准状态,要求氧气的体积还要进行体积的转化。300×0.75×22.4/273=18.5 L。
(7)1×106/27×3×105×6×10-3/3 600×0.6=1.1×104
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com