
题目列表(包括答案和解析)
6.地球上的海水中蕴藏了大约40万亿吨氘。从1升海水里提取的氘,在聚变反应中所释放的能量,相当于燃烧300升汽油。如果把自然界的氘和氚全部用于聚变反应,释放出来的能量足够人类使用100亿年。与核裂变相比,氘和氚的聚变能是一种安全、不产生放射性物质、原料成本低廉的能源。同温同压下有等质量的H2、D2、T2三种气体,下列叙述正确的是( )
①密度之比为1∶2∶3 ②质子数之比为6∶3∶2 ③中子数之比为0∶6∶8 ④体积之比为6∶3∶2
A.①②③④ B.只有①② C.只有③④ D.只有②④
解析:H2、D2、T2三种气体的式量分别为2、4、6,根据阿伏加德罗定律:同温同压下,气体的密度之比等于其相对分子质量(式量)之比,故①正确。其他选项,可设定三种气体的质量均为12 g,则②质子数之比为6∶3∶2。③中子数之比为:6mol×0×NA∶3mol×2NA∶2mol×4NA=0∶6∶8,③正确。④体积之比为:V(H2)∶V(D2)∶V(T2)=n(H2)∶n(D2)∶n(T2)=6∶3∶2,④正确。
答案:A
5.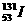 是人工合成的,常用于医疗上作放射性诊断。下列有关说法不正确的是( )
是人工合成的,常用于医疗上作放射性诊断。下列有关说法不正确的是( )
A.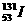 在元素周期表中位于ⅦA族
在元素周期表中位于ⅦA族
B.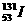 的半径比
的半径比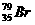 的大
的大
C.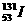 的质子数是53
的质子数是53
D.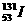 与
与 物理性质和化学性质相同
物理性质和化学性质相同
解析:A项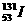 是碘元素的一种核素,与碘元素的其他核素一起都位于元素周期表的ⅦA族的同一位置上。B项
是碘元素的一种核素,与碘元素的其他核素一起都位于元素周期表的ⅦA族的同一位置上。B项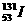 与其同位素有相同的核电荷数和电子数,而原子半径主要由核电荷数和核外电子数决定,所以
与其同位素有相同的核电荷数和电子数,而原子半径主要由核电荷数和核外电子数决定,所以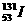 的半径大于
的半径大于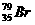 的原子半径。C项
的原子半径。C项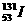 的质子数=核外电子数=荷电核数=53。D项
的质子数=核外电子数=荷电核数=53。D项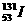 与
与 互为同位素,同位素的化学性质相同,但物理性质不完全相同。
互为同位素,同位素的化学性质相同,但物理性质不完全相同。
答案:D
4.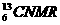 (核磁共振)可用于含碳化合物的结构分析,
(核磁共振)可用于含碳化合物的结构分析,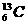 表示的碳原子( )
表示的碳原子( )
A.核外有13个电子,其中6个参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
解析:解本题的关键是:①理解符号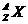 的含义,A代表质量数,Z代表质子数;②理清几个量之间的关系,质子数=核电荷数=核外电子数=原子序数,质量数=质子数+中子数。
的含义,A代表质量数,Z代表质子数;②理清几个量之间的关系,质子数=核电荷数=核外电子数=原子序数,质量数=质子数+中子数。
该题中的碳原子,其质量数=13,质子数=核电荷数=核外电子数=原子序数=6,中子数=质量数-质子数=13-6=7,又因为主族元素原子最外层的电子才参与成键,根据碳原子核外电子的排布情况可知,它只有4个电子能参与成键。
答案:D
3.在元素周期表中,第三、四、五、六周期元素的数目分别是( )
A.8、18、32、32 B.8、18、18、32
C.8、18、18、18 D.8、8、18、18
解析:此题主要考查核外电子的排布规律和元素周期表的结构。
答案:B
2.“神舟”五号载人飞船发射成功后,我国又在启动“嫦娥工程”,在不远的将来中国人将会登上月球。人类探测月球发现,其土壤中存在较丰富的质量数为3的氦,它可以作为核聚变的重要原料之一。以下叙述正确的是( )
A.由质量数为3的氦原子构成的分子是双原子分子
B. 与
与 的性质均相同
的性质均相同
C. 、
、 形成的分子中存在共价键
形成的分子中存在共价键
D. 中的质子数与
中的质子数与 的中子数相等
的中子数相等
解析:A项中由质量数为3的氦原子构成的分子仍然是单原子分子;B项 与
与 的化学性质相同,物理性质不同;C项
的化学性质相同,物理性质不同;C项 、
、 形成的分子为单原子分子,分子中不存在共价键。
形成的分子为单原子分子,分子中不存在共价键。
答案:D
1.下列各组物质中,互为同位素的是( )
A.重氢、超重氢 B.氧、臭氧
C.红磷、白磷 D.H2O、D2O
解析:同位素是指质子数相同,中子数不同的同一类原子的互称,所以,同位素首先必须是原子,因此,B、C、D项都不是。
答案:A
5.下面是钠和氯气反应的实验设计:
(1)实验步骤:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方,观察现象。
(2)记录实验现象
|
现象 |
|
|
化学方程式 |
|

钠与氯气反应
答案:钠首先熔化成闪亮的小球,然后剧烈燃烧,产生大量白烟
2Na+Cl2====2NaCl
30分钟训练(巩固类训练,可用于课后)
4.1933年,约里奥·居里夫妇发现了一个意义非常重大的现象,即人工放射性。他们用α粒子(质子数为2,质量数为4的He核)轰击铝原子时发现,先是有一种放射性的磷(P)原子生成,同时发射出中子,几分钟后,放射性的磷原子发射出正电子(质量等于负电子,带一个单位正电荷的电子),同时生成了一种硅(Si)原子。若用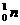 表示中子,
表示中子,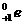 表示正电子,试用
表示正电子,试用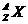 的形式写出α粒子、上述反应中生成的磷原子和硅原子的表示式:α粒子________________;P原子______________;Si原子______________。通过居里夫妇的实验,你能得出什么结论?(试写出两条)
的形式写出α粒子、上述反应中生成的磷原子和硅原子的表示式:α粒子________________;P原子______________;Si原子______________。通过居里夫妇的实验,你能得出什么结论?(试写出两条)
(1)___________________________________________________________________________。
(2)___________________________________________________________________________。
解析:本题是一道信息开放题,要求理解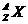 的含义。(1)(2)只要合理即可。
的含义。(1)(2)只要合理即可。
答案:
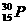
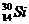
(1)原子可分
(2)核反应不是化学反应
3.有人认为在元素周期表中,位于ⅠA族的氢元素也可以放在ⅦA族,下列物质能支持这种观点的是( )
A.HF B.H3O+ C.NaH D.H2O2
解析:ⅦA族元素易得一个电子形成-1价阴离子,且达到稳定结构,氢元素如果能形成-1价阴离子,且达到稳定结构,即说明可以放在ⅦA族。在NaH中H为-1价,符合题意。
答案:C
2.下列说法正确的是( )
A.原子核都是由质子和中子构成的
B.不同元素原子的质量数一定不等
C.质子数决定元素种类,质子数和中子数决定原子种类
D.质子数相同的粒子,其核外电子数一定相同,但化学性质不一定相同
解析:当原子的原子核为氢原子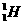 的原子核时,只由质子构成,因此A项不成立;不同元素原子质子数不同,但质量数可能相同,如
的原子核时,只由质子构成,因此A项不成立;不同元素原子质子数不同,但质量数可能相同,如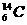 和
和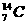 ,故B项错误;质子数相同的粒子可以是同种元素的原子和离子,其核外电子数可能不同,如Cl-和Cl,它们的化学性质也不同,故D项也错误。
,故B项错误;质子数相同的粒子可以是同种元素的原子和离子,其核外电子数可能不同,如Cl-和Cl,它们的化学性质也不同,故D项也错误。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com