
题目列表(包括答案和解析)
16.氯水可以跟碘化钾溶液发生置换反应,过量的氯水还可以把碘氧化为碘酸(HIO3),化学方程式为:5Cl2+I2+6H2O====2HIO3+10HCl。碘酸是一种无色晶体,极易溶于水。现有一瓶无色溶液,其中含有Br-和I-,请用氯水、四氯化碳和试管,设计一个简单的实验,证明该无色溶液中确实含有Br-和I-,写出实验步骤和现象。
(1)___________________________________________________________________________。
(2)___________________________________________________________________________。
(3)___________________________________________________________________________。
答案:(1)取少量无色溶液于试管中,加入少量CCl4,然后逐滴加氯水,边滴边振荡,见到CCl4层中有淡紫色出现,证明原溶液中含有I-
(2)静置,分层,取上层清液于另一试管
(3)向取出的清液中加入过量氯水后,再加入CCl4,振荡,静置分层,CCl4层为橙色,证明原溶液中有Br-
15.用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色褪去,试完成下列问题:
(1)实验室保存饱和氯水的方法是_________________________________________________。
(2)产生上述现象的原因可能有两种(简要文字说明):
①是由于_____________________________________________________________________;
②是由于_____________________________________________________________________。
简述怎样用实验证明红色褪去的原因是①或者是②
_____________________________________________________________________________。
答案:(1)在阴凉处置于棕色试剂瓶中密封保存
(2)①氯水与NaOH反应生成两种盐,碱性减弱
②氯气过量后HClO的漂白性将溶液变成无色,向无色溶液中再加入NaOH溶液,若不再出现红色,应为原因②,若再出现红色,应为原因①
14.位于短周期的四种主族元素A、B、C、D,原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。E是自然界中含量最高的金属。根据你的推断完成下列问题:
(1)B元素的名称为_____________,E的元素符号为_____________。
(2)由A、B两种元素形成的原子个数比为1∶1的化合物的电子式__________________。
(3)写出由上述元素形成的具有漂白作用的四种物质的化学式_________________________、___________________、_______________________、____________________。
(4)用电子式表示C与D形成化合物的过程_______________________________________。
(5)写出E的最高价氧化物与强碱反应的离子方程式_______________________________。
答案:(1)氧 Al
(2) 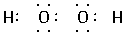
(3)SO2 O3 H2O2 Na2O2
(4)Na·+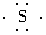 +·Na→Na+[
+·Na→Na+[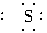 ]2-Na+
]2-Na+
(5)Al2O3+2OH-====2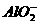 +H2O
+H2O
13.如图,在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
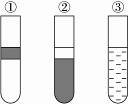
A.①加入的是CCl4,②加入苯,③加酒精
B.①加入的是酒精,②加入CCl4,③加苯
C.①加入的是苯,②加入CCl4,③加酒精
D.①加入的是苯,②加酒精,③加CCl4
解析:溴水在四氯化碳、苯、酒精中的溶解度远远大于在水中的溶解度。酒精与水互溶。四氯化碳不溶于水、比水的密度大,它将溴水萃取于下层。苯不溶于水,比水的密度小,它将溴水萃取于上层。
答案:C
12.设某元素原子核内的质子数为m,中子数为n,则下列论断正确的是( )
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为m+n
C.若碳12原子质量为W g,此原子的质量为(m+n)W g
D.该原子核内中子的总质量小于质子的总质量
解析:B选项m+n为质量数,是同位素相对原子质量的近似值,不是元素的相对原子质量。
C选项此原子的质量近似等于(m+n)×W/12 g。
D选项不一定,若为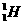 ,则中子质量小于质子质量,若为
,则中子质量小于质子质量,若为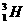 ,则中子质量大于质子质量。
,则中子质量大于质子质量。
答案:A
11.钾的金属活动性比钠强,根本原因是( )
A.钾的密度比钠的小
B.钾原子的电子层比钠原子多一层
C.钾与水反应比钠与水反应更剧烈
D.加热时,钾比钠更易汽化
解析:金属活动性属于化学性质,化学性质决定于原子的结构,K原子半径大,易失电子。
答案:B
10.下列离子中,所带电荷数与该离子的核外电子层数相等的是( )
A.Al3+ B.Mg2+ C.Be2+ D.H+
解析:Al3+、Mg2+核外电子层数都为2,Be2+核外电子层数为1,H+核外电子层数为0,故B正确。
答案:B
9.甲、乙是周期表中同一周期的两种元素,甲在ⅡA族,乙在ⅢA族,那么甲、乙两元素的原子序数之差不可能是( )
A.1 B.11 C.25 D.10
解析:甲、乙两元素同在第二、第三周期时,原子序数之差为1;同在第四、第五周期时原子序数之差为10;同在第六、第七周期时,原子序数之差为25,所以不可能为11。
答案:B
8.我国自行安装的秦山核电站所用的燃料为铀235的氧化物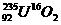 ,下列与之有关的说法正确的是( )
,下列与之有关的说法正确的是( )
A.1 mol此氧化物中含质子100 mol
B.铀的相对原子质量为235
C.U-235与U-238属于同一种核素
D.1 mol 此氧化物所含中子数是阿伏加德罗常数的159倍
解析:本题是一道综合性较强的题目,涉及的概念较多。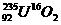 表示UO2这种氧化物含有
表示UO2这种氧化物含有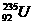 和
和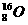 两种核素。U-235与U-238属于同位素,是铀元素的两种不同核素。相对原子质量分为元素的相对质量和原子的相对原子质量,显然
两种核素。U-235与U-238属于同位素,是铀元素的两种不同核素。相对原子质量分为元素的相对质量和原子的相对原子质量,显然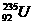 的质量数并不代表铀元素的相对原子质量。1 mol
的质量数并不代表铀元素的相对原子质量。1 mol 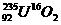 所含的质子数应为108,含中子数为159,选D。
所含的质子数应为108,含中子数为159,选D。
答案:D
7.根据等电子原理:由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特征。以下各组粒子结构不相似的是( )
A.CO和N2
B.O3和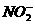
C.CO2和N2O D.N2H4和C2H4
解析:上述各物质的电子数分别是CO:14、N2:14;O3:24、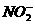 :24;CO2:22、N2O:22;N2H4:18、C2H4:16,所以不是等电子体的是D选项。
:24;CO2:22、N2O:22;N2H4:18、C2H4:16,所以不是等电子体的是D选项。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com