
题目列表(包括答案和解析)
7.X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。
请针对以下两种不同情况完成下列问题:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是____________________________________________________________;
②生成固体C的化学方程式是_______________________________________________。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是___________________________________________________________;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是___________________;
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
_____________________________________________________________________________。
解析:(1)常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则A和B是NH3和HCl,C为NH4Cl,又因Y+X→A(气),Y+Z→B(气),故Y为H2。
(2)常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则Y为S,X为H2,Z为O2。
答案:(1)①H2 ②NH3+HCl====NH4Cl
(2)①SO2 ②H2S+OH-====HS-+H2O ③S+3Cl2+4H2O====H2SO4+6HCl
30分钟训练(巩固类训练,可用于课后)
6.根据教材所附元素周期表判断,下列叙述不正确的是( )
A.K层电子数为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子数为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子数为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
解析:K层电子数为奇数的只有H元素,其族序数与K层电子数相等(都是1)。L层电子数为奇数时,只能是第二周期元素Li、B、N、F;为偶数(2、4、6)时,可以是第二周期元素中的Be、C、O,其族序数与L层电子数相等。但L层电子数为8(偶数)时,可以是氖及原子序数大于10的所有元素,其族序数与L层电子数(8)均不相等。M层电子为奇数(1、3、5、7)时,只能是第三周期元素(Na、Al、P、Cl),其族序数与L层电子数均相等。
答案:C
5.运用元素周期律分析下面的推断错误的是( )
A.铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性
B.砹单质是一种有色固体,砹化氢很不稳定,砹化银是有色、难溶于水且感光性很强的固体
C.硫酸锶难溶于水,但易溶于盐酸
D.硒化氢是无色、有毒、比硫化氢稳定的气体
解析:铍在周期表中与铝处于对角线位置,性质相似,所以A项正确;砹为卤族元素,根据卤素性质递变规律(从上到下,单质的颜色变深、气态氢化物的稳定性减小、卤化银的颜色变深且感光性增强),B项也正确;锶与钙处于同一主族,性质相似且有递变性,则硫酸锶难溶于水(硫酸盐的溶解度减小),但也不溶于盐酸,所以C项错误;硒和硫处于同一主族,根据性质的递变性可知,硒化氢的稳定性应小于硫化氢,所以D项也错误。
答案:CD
4.具有相同电子层数的X、Y、Z三种元素,已知它们最高价氧化物对应水化物酸性由强到弱的顺序是HXO4、H2YO4、H3ZO4,则下列判断不正确的是( )
A.X、Y、Z三种元素在周期表中的位置依次是ⅦA、ⅥA、ⅤA
B.原子半径X>Y>Z
C.元素原子的得电子能力X>Y>Z
D.气态氢化物的化学式依次是HX、H2Y、ZH3
解析:首先由电子层数相同确定X、Y、Z三种元素处于同一周期,再由最高价氧化物对应水化物的化学式及酸性强弱顺序可以判断X、Y、Z的最高正价依次是+7、+6、+5,族序数依次是ⅦA、ⅥA、ⅤA(从左到右依次是Z、Y、X),所以原子半径Z>Y>X,原子的得电子能力X>Y>Z。气态氢化物的稳定性与元素原子得电子能力顺序一致,是HX>H2Y>ZH3,气态氢化物HX、H2Y、ZH3的还原性实际上就是X-、Y2-、Z3-的还原性,而X-、Y2-、Z3-的还原性顺序恰好与X、Y、Z的氧化性顺序相反,即气态氢化物的还原性与元素原子得电子能力顺序正好相反,是ZH3>H2Y>HX。由最高正化合价可以判断负化合价依次为-1、-2、-3,由此确定气态氢化物的化学式依次是HX、H2Y、ZH3。
答案:B
3.下列各组元素性质递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的金属性依次增强
解析:根据元素周期律可知:随原子序数的递增,原子结构、原子半径、元素的化合价、元素的金属性和非金属性呈现规律性的变化。Li、Be、B最外层电子数依次为1、2、3,A项正确;P、S、Cl元素最高正价依次为+5、+6、+7,B项正确;N、O、F属于同一周期元素,且从左到右排列,原子半径依次减小,故C项错误;Na、K、Rb属同一主族,电子层数依次增多,失电子能力增强,即金属性依次增强,D项也正确。
答案:C
2.下列事实能说明氯元素原子得电子能力比硫元素强的是( )
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S强 ④HCl的还原性比H2S强 ⑤HClO的酸性比H2SO4强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧 ⑨还原性:Cl-<S2-
A.③④⑤⑦⑧⑨ B.③⑥⑦⑧
C.③⑥⑦⑧⑨ D.①②③④⑤⑥⑦⑧⑨
解析:①②两项不能说明元素原子的得失电子能力强弱;③是正确的;④项的顺序反了,应该是H2S的还原性比HCl强;⑤项中HClO不是最高价含氧酸;⑥项的非金属单质在相同条件下与变价金属反应,产物中变价金属的价态越高,说明非金属元素原子得电子能力越强;⑦项是作为氧化剂的非金属单质在水溶液中置换另一种非金属单质;⑧项是利用元素在周期表中的相对位置进行判断的;⑨项是利用逆向思维来进行判断的。
答案:C
1.下列叙述正确的是( )
A.核外电子排布完全相同的两种粒子的化学性质一定相同
B.单原子形成的离子一定具有稀有气体元素原子的核外电子排布
C.核外电子排布相同的两种原子一定属于同种元素
D.不存在质子数和电子数都相同的阳离子和阴离子
解析:本题主要是通过粒子的核外电子排布来强化对质子和电子的数量关系的认识,并熟练掌握核外电子排布相同的原子、阴离子、阳离子的本质联系。核外电子排布完全相同的两种粒子可能是原子、阴离子、阳离子三种情况中的一种或者几种,如果是同一元素的两种核素,化学性质应该相同,如果不是同一元素的两种核素,其他符合题目要求的两种粒子的化学性质肯定不同,并且有的悬殊还很大,所以A选项是错误的;我们熟悉的元素的单原子形成的离子一般具有稀有气体元素原子的核外电子排布,但也有特例,如H+核外电子数是0,不存在电子数为0的稀有气体元素的原子,所以B选项是错误的;核外电子排布相同即电子数相同,又因为都是原子,所以质子数也相同,质子数相同的不同原子必定是同位素关系,所以C选项是正确的;如果阴、阳离子的电子数相同,则其质子数必定不同,反之亦然,所以不存在质子数和电子数分别相同的阳离子和阴离子,D选项也是正确的。
答案:CD
3.在1-20号元素中(稀有气体除外),按要求用化学符号或用化学方程式完成下列问题:
(1)原子半径最小的是_________________,半径最大的是_________________。
(2)与水反应最剧烈的金属单质是__________;与水反应最剧烈的非金属单质是__________。
答案:(1)H K
(2)K F2
10分钟训练(强化类训练,可用于课中)
2.十九世纪中叶,门捷列夫总结了如图所示的元素化学性质的变化状况。

试完成下列问题:
(1)门捷列夫的突出贡献是___________________________________________________。
(2)图中变化表明( )
A.事物的性质总是在不断变化的
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.ⅠA族元素的金属性肯定比ⅡA族元素的金属性强
D.量变到一定程度必然引起质变
(3)从ⅢA族的硼到ⅦA族的砹连成一条斜线,即为金属和非金属的分界线,从分界线附近可以找到( )
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
解析:(1)门捷列夫的突出贡献是发现了元素周期律,并根据元素周期律排出了第一张元素周期表。通过对化学史知识的了解,培养我们严谨的科学态度。
(2)借助于题图所示,应明白氦是稀有气体元素,性质稳定。而ⅠA族的Li、Na的金属性比ⅡA族的Ca弱。随着原子序数的递增,同一横行由金属元素过渡到非金属元素,如题图中Al变化到Si;同一纵行由非金属元素过渡到金属元素,如题图中As变化到Sb。因而本题借助元素周期律研究元素周期表中元素性质的变化,验证了唯物辩证法的一个基本观点:量变到一定的程度引起质变。
(3)耐高温材料和新型催化剂材料在副族元素中寻找;F、Cl、Br、I是制造新型农药的材料;金属与非金属分界线附近寻找半导体材料。
答案:(1)发现元素周期律,并绘制了第一张元素周期表
(2)D
(3)C
1.据报道,月球上有大量的3He存在。以下有关3He的说法正确的是( )
A.原子核外有两个电子层 B.核外有2个电子
C.比4He多一个电子 D.比4He少一个质子
解析:3He也是He元素中同位素的一种,原子符号为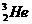 ,原子结构示意图为
,原子结构示意图为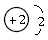 。4He也是He元素中同位素的一种,原子符号
。4He也是He元素中同位素的一种,原子符号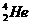 。
。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com