
题目列表(包括答案和解析)
10.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D>C
B.原子序数d>c>b>a
C.离子半径C>D>B>A
D.单质的还原性A>B>D>C
解析:短周期元素形成的离子都具有稀有气体原子的结构,其中阳离子在它的下一周期,阴离子与其在同一周期。再根据离子所带的电荷数,可确定原子序数为a>b>d>c,所以B项错误。根据原子半径的递变规律知,它们的原子半径由大到小的顺序为B>A>C>D,所以A项错误。电子层结构相同的离子半径(包括阴、阳离子)随核电荷数的增加而减小,则C项正确。原子半径越大,其单质的还原性越强,还原性由强到弱的顺序为B>A>C>D。
答案:C
9.X、Y是元素周期表ⅦA族的两种元素,下列叙述能说明X的非金属性比Y强的是( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
解析:根据同主族元素性质的递变规律可知:电子层数越多,非金属性越弱,A项不正确;物质熔沸点的高低,与非金属性强弱无关,B项不正确;非金属元素气态氢化物的稳定性越强,最高价氧化物对应水化物的酸性越强,则其非金属性越强,C项正确;根据氧化还原反应中氧化性:氧化剂>氧化产物,有Y的氧化性大于X,显然D项也不符合题意。
答案:C
8.1999年世界重大科技成果之一是超铀元素的发现,它有力地支持了“稳定岛”假说。原子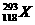 的中子数与电子数之差为( )
的中子数与电子数之差为( )
A.0 B.57 C.118 D.175
解析:根据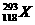 ,电子数等于质子数为118,中子数为293-118=175,中子数和电子数之差为175-118=57。
,电子数等于质子数为118,中子数为293-118=175,中子数和电子数之差为175-118=57。
答案:B
7.已知铍(Be)的原子序数为4,下列关于铍及其化合物的叙述正确的是( )
A.铍的原子半径大于硼的原子半径
B.氯化铍分子中铍原子的最外层电子数为8
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟冷水反应产生氢气
解析:掌握元素周期律及其具体变化内容,是解此题的关键。A项,因同周期元素的原子半径从左到右逐渐减小,故A项正确。同主族元素从上到下金属性增强,最高价氧化物对应水化物的碱性增强,所以C项正确。氯化铍中铍原子的最外层电子数为4而不是8;铍的金属性弱于镁,与冷水更难作用。所以B、D都不正确。
答案:AC
6.下列叙述正确的是( )
A.同周期元素中ⅦA族元素的相对原子质量大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,零族元素的单质都是气体
D.所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等
解析:此题主要考查元素周期表中,同周期、同主族元素性质的一些递变规律。在同周期中,零族元素的原子半径最大,而在同主族中,半径越大,越难得电子;单原子离子的化合价和它的族序数不一定相等,如ⅣA族铅形成的Pb2+。
答案:C
5.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是( )
A.X的原子序数比Y的小
B.X原子的最外层电子数比Y的多
C.X的原子半径比Y的大
D.X元素的最高正价比Y的小
解析:X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,则它们的相对位置是X在Y的下一周期,由此对照选项可得解。
答案:CD
4.原子序数为z的元素R,在周期表中位于A、B、C、D四种元素的中间,A、B、C、D四种元素的原子序数之和为下列数据,其中不可能的是( )

A.4z B.4z+10 C.4z+5 D.4z+14
解析:由周期表的结构可知C与R或R与D的原子序数之差可能为8、18、32,即C、D原子序数之和存在三种情况:2z、2z+10、2z+14,A、B原子序数之和为2z。
答案:C
3.A、B、C、D、E五种元素具有相同的电子层数,A、B的最高价氧化物对应水化物水溶液呈碱性,且碱性B>A;C、D的最高价氧化物的水化物的水溶液呈酸性,且酸性C>D;五种元素所形成的简单离子中,E的离子半径最小。则它们的原子序数由大到小的顺序正确的是( )
A.CDEAB B.ECDAB C.BAEDC D.BADCE
解析:A、B、C、D、E五种元素具有相同的电子层数,即这五种元素在同一周期。同周期中,随原子序数的递增,元素金属性减弱(对应最高价氧化物的水化物水溶液碱性减弱),非金属性增强(对应最高价氧化物的水化物的水溶液酸性增强)。故原子序数B<A、C>D,即C>D>A>B。金属元素原子形成阳离子,电子层数相同,核电荷数越大,离子半径越小,故E>A>B;非金属元素原子形成阴离子,电子层数比A、B、E的离子多一层,故C>D>E>A>B。
答案:A
2.第四周期某主族元素的原子,它的最外电子层上有两个电子,则关于此元素的叙述正确的是( )
A.原子半径比钾的原子半径大 B.氯化物难溶于水
C.原子半径比镁的原子半径大 D.碳酸盐难溶于水
解析:先由核外电子排布确定元素的位置,再进行判断。主族元素最外层上有两个电子,说明该元素处于ⅡA族,又在第四周期,则为钙元素。同周期元素原子半径从左到右逐渐减小,同主族元素原子半径从上到下增大,则A项错误,C项正确。又知氯化钙易溶,碳酸钙难溶。
答案:CD
1.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为( )
A.XY B.XY2 C.XY3 D.X2Y3
解析:由于X和Y是短周期元素,X原子的最外层电子数是次外层电子数的一半,X可以有两种情况:Li或Si。若X为Li,则Y为H,形成XY型化合物;若X为Si,则Y为Li,化合物的化学式不符合选项。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com