
题目列表(包括答案和解析)
5.已知32gX与40gY恰好完全反应,生成mgQ和9gH。在相同条件下,16gX和30gY混给予反应生成0.25molQ和若干物质的量的H,则物质Q的摩尔质量是
A.63g/mol B.122g/mol C.126g/mol D.163g/mol
4.NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.2.3g钠由原子变成离子时,失去的电子数目为0.2NA
B.0.2NA个硫酸分子与19.6g磷酸分子含有相同的氧原子数
C.28g氮气所含原子数为NA
D.NA个氧分子与Na个氢分子的质量比为2:1
3.在一个密闭容器内有X、Y、Z、Q四种物质,在一定条件下进行反应,一段时间后测得反应前后各物质质量如下:
|
物质 |
X |
Y |
Z |
Q |
|
反应前质量/g |
20 |
20 |
20 |
20 |
|
反应后质量/g |
20 |
30 |
16 |
14 |
该密闭容器中发生化学反应的基本类型可能是( )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
2.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A. Fe+CuSO4=FeSO4+Cu
B.3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
C.AgNO3+NaCl=AgCl↓+NaNO3 D.2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
1.右图为农夫山泉矿泉水瓶上的部分说明文字,列出了该饮用天然水理化指标。这里的钙、镁、钾、钠是指( )
 A.原子
B.分子 C.单质 D.元素
A.原子
B.分子 C.单质 D.元素
15.下表是元素周期表的一部分。
|
周期 族 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
1 |
① |
|
|||||
|
2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
|
3 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)表中元素⑩的氢化物的化学式为_________________,此氢化物的还原性比元素⑨的氢化物的还原性_______________(填“强”或“弱”)。
(2)俗称为“矾”的一类化合物通常含有共同的元素是_______________。
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式:________________________。
又如表中与元素⑦的性质相似的不同族元素是_______________ (填元素符号)。
解析:(1)同周期从左到右非金属性逐渐增强,其氢化物的稳定性增强,还原性减弱。
(2)如蓝矾CuSO4·5H2O,绿矾FeSO4·7H2O等都含有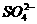 和结晶水。
和结晶水。
(3)依题意在周期表中左上角与右下角相邻元素的相似性即对角线规律,Be的左上角是Li,右下角是Al。
答案:(1)HCl 弱 (2)H、O、S
(3)Be(OH)2+2NaOH====Na2BeO2+2H2O Li
14.短周期的三种元素X、Y、Z,原子序数依次减小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素最外电子层上的电子数的和;Y元素原子最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请完成下列问题:
(1)X元素的名称是_____________________;Y元素的名称是____________________;Z元素的名称是______________________。
(2)XZ3化合物的化学式是_____________。
(3)分别写出X、Y的含氧酸的化学式:_____________、_____________。
解析:先考虑Y元素:①如果Y元素的电子层数为1,则最外层电子数为2,是He元素,不合题意;②如果Y元素的电子层数为2,则最外层电子数为4,是C元素;③如果Y元素的电子层数为3,则最外层电子数为6,是S元素。根据X、Y、Z的原子序数依次减小,可知X的电子层数也等于3,与“三元素电子层数之和是5”不符,所以Y元素为C,电子层数为2。可以推出,X的电子层数为2,Z的电子层数为1,Z应为H元素;X能与Z形成XZ3的化合物,X应为N元素,所以XZ3为NH3。
答案:(1)氮 碳 氢
(2)NH3 (3)HNO3 H2CO3
13.A、B、C、D、E分别代表五种粒子,每种粒子中都含有18个电子,其中A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性。请完成下列问题:
(1)用化学符号表示上述5种粒子:
A________________________,B________________________,C________________________,D________________________,E________________________。
(2)在水溶液中A跟B反应的离子方程式________________________________________。
解析:常见的具有18个电子的粒子有:①分子或原子,如SiH4、PH3、H2S、HCl、Ar、F2;②离子,如S2-、Cl-、K+、Ca2+。
对照题目给出的信息可知,A为S2-;B为HCl;C为Cl-;D为H2S;E为F2。
在水溶液中A跟B反应的离子方程式为S2-+ 2H+====H2S↑。
答案:(1)S2- HCl Cl- H2S F2
(2)S2-+ 2H+====H2S↑
12.下列实验事实,能证明元素金属性、非金属性强弱的是___________________________。
(1)钠和水反应比镁和水反应剧烈,证明金属性钠强于镁
(2)氢氧化铝能溶于氢氧化钠溶液,而氢氧化镁不溶于氢氧化钠溶液,证明金属性镁强于铝
(3)向氢硫酸溶液中滴加氯水,出现浑浊现象,证明非金属性氯强于硫
(4)同浓度的盐酸和氢硫酸溶液,前者的酸性强,证明非金属性氯强于硫
解析:元素金属性强弱的判断依据主要有:①金属与水、酸反应,置换出氢的难易。反应越剧烈,金属性越强,(1)能证明。②最高价氧化物对应水化物水溶液的碱性,碱性越强,金属性越强。氢氧化铝能溶于氢氧化钠溶液中,说明氢氧化铝具有两性,其碱性弱于氢氧化镁,故(2)也能证明。
元素非金属性强弱的判断依据主要有:①与H2化合的难易及氢化物的稳定性;②最高价氧化物对应水化物的水溶液的酸性,酸性越强,非金属性越强,但不是氢化物溶于水的酸性,故(4)不能证明。③单质氧化性的强弱,氧化性越强,非金属性越强。而Cl2+ H2S====2HCl+S↓,说明氧化性Cl2>S,所以(3)能证明。
答案:(1)(2)(3)
11.X、Y、Z三种元素,已知X和Y元素的原子核外电子层数相同,Y和Z元素的原子最外层电子数相同。三种元素原子最外层电子数总和为14,而质子数总和为28,则这三种元素为( )
A.N、P、O B.N、C、Si C.B、Mg、Al D.C、N、P
解析:X和Y原子核外电子层数相同,则二者同周期。Y和Z原子最外层电子数相同,则二者同主族。X、Y、Z三种元素最外层电子数之和为14,讨论推知:可以为6、4、4(即C、Si、O)或4、5、5(即C、N、P),结合质子数总和为28,可得D选项正确。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com