
题目列表(包括答案和解析)
29(6分).Cu、Cu2O和CuO组成的混合物,加入100mL0.6mol∙L-1HNO3溶液恰好使混合物溶解,同时收集到224mLNO气体(标准状况)。求:
(1)写出Cu2O跟稀硝酸反应的化学反应方程式________________。
(2)如混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量分别是________mol、__________mol。
(3)如混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量________________、_______________。
28、(4分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
⑴ 化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol
则E(H-Cl)= ;
⑵ 1840年瑞士的化学家盖斯(Hess)在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
请写出CO还原FeO的热化学方程式: ;
27.(6分)某学生为了测定由两种元素形成的气态化合物X的组成,做了如下图所示的实验。他把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应,得到如下结果:
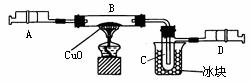
①实验前B管和药品的总质量为21.32g,实验后为21.16g。
②C管中收集到的物质电解后得到H2和O2,在D中收集到的是N2。
③X中两元素的质量比是14︰3,问:
(1)C中收集到的液体,质量是 g。
(2)在实验中看到的现象是 。
(3)B中反应的化学方程式是 。
26、(10分)已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍
(1)请写出元素符号X_________,Y_________,Z_________,W________
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为
_____________________;E的水溶液显______性,原因可表示为______________________;E在催化剂存在的条件下,可用于还原汽车尾气中的_____________以减少对大气的污染。
(3)这四种元素可组成原子个数比为5:1:1:3的化合物,该化合物的水溶液与足量烧碱溶液混合反应的离子方程式为______________________________________
(4)将9克Y单质在足量W单质中燃烧,所得气体通入1L1mol/L的烧碱溶液中,完全吸收后,溶液中的溶质及其物质的量分别为_______________________________
25、(6分)溶液A可能含有等物质的量浓度的Cl-、AlO2-、S2-、SiO32-、SO32-、CO32-、SO42-、PO43-中的几种,现进行以下实验:
①取5mL A溶液,往其中通入足量的CO2,得到白色沉淀B,B可完全溶解于盐酸。
②另取5mL A溶液,往其中加入盐酸,生成气体C,将C通入CuSO4溶液中,有黑色沉淀D生成。
根据以上事实,回答以下问题:
(1)溶液A中肯定存在的离子是________________。(2)溶液A中肯定不存在的离子是________________。
24、(6分)将等物质的量A、B混合于2L的密闭容器中,发生如下反应:
 ,经4min后,测得D的浓度为0.4mol/L,
,经4min后,测得D的浓度为0.4mol/L,
c(A)︰c(B)=3︰5,C的平均反应速率是0.1 mol·(L ·min) -1。
(1)A在4min末的浓度是_ ,
(2)B在4min内的平均反应速率_ ,ks**5u
(3)x值是多少_ 。
23、列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量B跟Cl2反应除生成C外,另一产物是盐酸盐。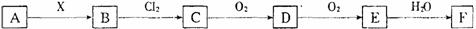
下列说法下正确的是
A 当x是强酸时,A、B、C、D、E、F均含同一种元素,F是H2SO4。
B 当x是强碱时,A、B、C、D、E、F均含同一种元素,F是HNO3。
C B和Cl2的反应是氧化还原反应
D 当X是强酸时,C常温下是气态单质
22、某温度下将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合物,今测得ClO-与ClO3-离子浓度之比为1:3,则Cl2与NaOH反应时,被还原的氯元素与被氧化的氯元素物质的量之比为
A、21:5 A、11:3 C、3:1 D、4:1
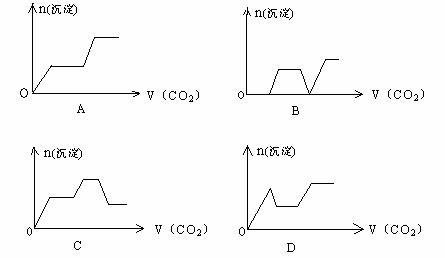
21.将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
20..在给定条件下,下列加点的物质在化学反应中完全消耗的是
A.用50mL8mol·L-1浓盐酸与10g二氧化锰共热制取氯气
B.标准状况下,将1g铝片投入20mL18.4mol·L-1的硫酸中ks**5u
C.向100mL3mol·L-1的硝酸中加入5.6g铁
D.在5×107Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com