
题目列表(包括答案和解析)
28.(10分)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应
条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请回答;
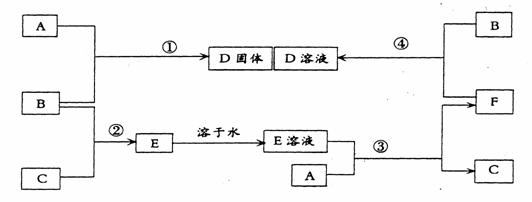
(1)A是__________、B是___ _____(请填化学式)。
(2)反应①的化学方程式为:________________________________。
(3)反应③的离子方程式为:________________________________。
(4)反应④的化学方程式为:________________________________。
27.(10分)某无色溶液可能含有下列钠盐中的几种:(A)氯化钠 (B)硫化钠 (C)亚硫酸钠 (D)硫代硫酸钠 (E)硫酸钠 (F)碳酸钠.向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同时有气体产生.此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。(已知:硫代硫酸钠的化学式为Na2S2O3, 硫代硫酸钠与稀硫酸的反应式为:
Na2S2O3+H2SO4=== Na2SO4+SO2↑+S↓+H2O)
根据上述实验现象回答下列问题.
(1)不能使品红试液褪色,说明该气体中不含____________(填分子式).
(2)此无色溶液中至少可能存在哪几种钠盐?请写出全部可能的情况(填写相应的字母).
第一种情况是______ ______,第二种情况是____ ________,
第三种情况是_________ ___,第四种情况是______ ______.
(可不填满,也可补充)
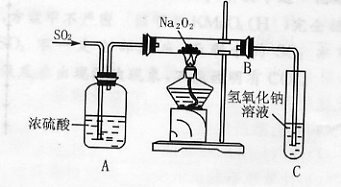
26.(10分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
 www.k@s@5@
高#考#资#源#网
www.k@s@5@
高#考#资#源#网
请回答下列问题。
(1)第一小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
(2)请设计一简单实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3
。
(3)第二小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理? 。请简要说明两点理由:
① ;② 。
25. 下列反应的离子方程式正确的是 A、次氯酸钙溶液中通入过量二氧化碳 Ca2++2ClO-+H2O+CO2 == CaCO3¯+2HClO B、硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+ == Fe3++4H2O
C、用氨水吸收少量二氧化硫
2NH3 .H2O+SO2 == 2NH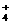 +SO2
+SO2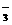 +H2O
+H2O
D、硝酸铁溶液中加过量氨水
Fe3++3NH3.H2O == Fe(OH)3¯+3NH
第II卷(40分)
第三题:(包括4个小题,共40分)
24. 在右图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤
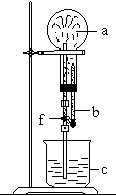 入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体c
入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体c
呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是
|
|
a(干燥气体) |
b(液体) |
|
A |
NO2 |
水 |
|
B |
CO2 |
4mol/LNaOH溶液 |
|
C |
Cl2 |
饱和NaCl水溶液 |
|
D |
NH3 |
1mol/L盐酸 |
23. 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等因素有关。下列各组物质中由于浓度不同而能发生不同氧化还原反应的是
A.Cu与HNO3溶液 B.Cu与FeCl3溶液
C. Zn与H2SO4溶液 D.Fe与HCl溶液
22. 硫代硫酸钠可作为脱氯剂,已知25.0mL0.100mol/LNa2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成
A.S2- B.S C.SO32- D.SO42-
21. 某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物.当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是
A.NO2 B.NO C.N2O D.NH4NO3
20.38.4毫克铜跟适量的浓硝酸反应,铜全部作用后共收集到气体22.4毫升(标准状况),反应消耗的HNO3的物质的量可能是
A.1.0×10-3摩尔 B.1.6×10-3摩尔 www.k@s@5@ 高#考#资#源#网
C.2.2×10-3摩尔 D.2.0×10-3摩尔
19.硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水.反应中生成的氧化产物和还原产物的物质的量之比是(已知反应方程式为:3(NH4)2SO4===4NH3+3SO2+N2+H2O)
A.1:3 B.2:3 C.1:1 D.4:3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com