
题目列表(包括答案和解析)
25. (10分)已知有关物质的熔、沸点数据如下表:
|
|
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
熔点(℃) |
2852 |
2045 |
714 |
190(2.5×105Pa) |
|
沸点(℃) |
3600 |
2980 |
1412 |
177.8 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁;用电解Al2O3与冰晶石熔融混合物的方法生产铝。不用电解MgO的方法生产镁的原因是:___▲____; AlCl3可能为___▲____晶体。
(2)请设计可靠的实验证明MgCl2、AlCl3所属化合物的类型,其实验方法是_____▲____ 。
(3)AlCl3具有以下__▲__特殊性质(请填序号)。①液化 ②挥发 ③升华
24.
(5分)有下列四种微粒: ①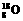 ,②
,② ,③
,③ ,④
,④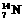 。(填序号)
。(填序号)
(1)微粒中质子数小于中子数的是____▲___。
(2)在化合物中呈现的化合价的数值最多的是__▲_。
(3)能形成X2Y2型化合物的是__▲____,电子式为 ▲ ;能形成X3Y2型化合物的是___▲____。
23. (8分)下表为元素周期表的一部分,请回答有关问题:
|
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0A |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑧的元素符号是__▲__和__▲__ ;
(2)表中最活泼的金属是__▲_ ,非金属性最强的元素是_▲__(填写元素符号);
(3)表中能形成两性氢氧化物的元素是__▲_ ,分别写出该元素的氢氧化物与⑥最高价氧化物对应水化物反应的化学方程式: ___________▲____________ ,
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:_________▲_________ 。
(5)0.1 mol的单质⑦与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+ 和Br-的物质的量之比是: __▲__。
22. (5分)根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(1)写出Be与NaOH溶液反应生成Na2BeO2的离子方程式 ▲ ;
(2)Be(OH)2与Mg(OH)2可用__▲___试剂鉴别,其反应离子方程式为 ▲ 。
(3)Li和Mg根据对角线规则,性质也相似,则Li在空气中燃烧,主要产物的化学式是__▲____;同时还有少量 ▲ 生成。
21. (4分)有A、B、C、D四种元素,A元素是地壳中含量最多的金属元素;B元素的原子其M层电子数比L层少1个电子;C元素的原子得到2个电子、D元素的原子失去1个电子所得到的微粒都具有与氖原子相同的电子层结构。回答下列问题: (1)上述四种元素中C的名称是______▲__________;
(2)画出B元素原子的结构示意图________▲________ ;
(3)写出下列化学方程式:
单质D在单质C中燃烧的化学方程式______▲__________ ;.k*s5*u
A的氢氧化物和D的氢氧化物反应的离子方程式_________▲_______ 。
20. 将N2、H2的混合气体分别充入甲、乙、丙三个容器中,进行合成氨反应,经过相同的一段时间后,测得反应速率分别为:甲:v(H2)=3 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=1 mol·L-1·min-1。则三个容器中合成氨的反应速率 A.v(甲)> v(乙)> v (丙) B.v(乙)>v(丙)>v(甲) C.v(丙)> v(甲)> v (乙) D.v(乙)>v(甲)>v(丙)
第Ⅱ卷(非选择题 共60分)
19. 假设原子核外电子排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2个。如果按此规律排布周期表,那么该周期表第3、4、5周期含有的元素分别有 A.5种,10种,15种 B.8种,18种,18种
C.8种,10种,15种 D.9种,12种,15种
18. 硫可以形成分子式为S2、S4、S6、S8的单质,其中S8的分子结构如图所示。下列有关说法正确的是
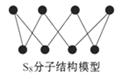 A.S2、S4、S6、S8互为同位素
A.S2、S4、S6、S8互为同位素
B.S2的摩尔质量为32 g/mol C.硫的单质在足量的空气中完全燃烧可生成SO3
D.1 mol S8单质中含有的S-S键个数为8NA
17. 自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列一定能说明CaF2是离子晶体的实验是
A.CaF2难溶于水,其水溶液的导电性极弱 B.CaF2的熔、沸点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电 D.CaF2在有机溶剂(如苯)中的溶解度极小
16.
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体--黑磷,其转化过程如下:白磷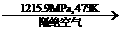 黑磷,黑磷性质稳定,结构与石墨相似。下列叙述正确的是.k*s5*u
黑磷,黑磷性质稳定,结构与石墨相似。下列叙述正确的是.k*s5*u
A. 黑磷与白磷互为同位素 B. 黑磷能导电
C. 白磷转化为黑磷是物理变化 D. 黑磷能在空气中自燃
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com